Soru Çözümü
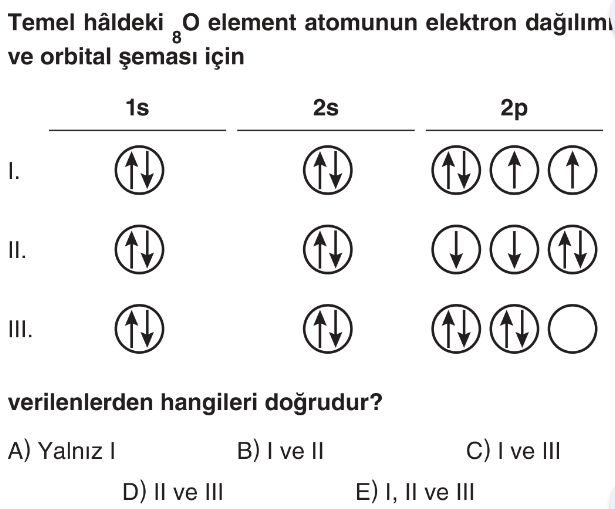
- Oksijen atomunun ($_8O$) atom numarası $8$'dir, yani temel hâlde $8$ elektrona sahiptir.
- Temel hâl elektron dağılımı Aufbau Prensibi'ne göre $1s^2 2s^2 2p^4$ şeklindedir.
- Bu dağılımda $1s$ orbitalinde $2$, $2s$ orbitalinde $2$ ve $2p$ orbitallerinde $4$ elektron bulunur.
- Pauli Dışlama Prensibi'ne göre bir orbitalde en fazla iki elektron zıt spinli olarak bulunabilir.
- Hund Kuralı'na göre eş enerjili orbitallere (burada $2p$ orbitalleri) elektronlar önce aynı spinle tek tek yerleşir, sonra zıt spinle ikinci elektronlar yerleşir.
- I. durum: $1s^2 2s^2 2p^4$ dağılımını doğru gösterir. $2p$ orbitallerinde $4$ elektron, Hund Kuralı'na uygun olarak bir orbitalde çift, diğer iki orbitalde tek ve aynı spinli olarak yerleşmiştir. Bu şema doğrudur.
- II. durum: $1s^2 2s^2 2p^4$ dağılımını doğru gösterir. $2p$ orbitallerinde $4$ elektron, Hund Kuralı'na uygun olarak bir orbitalde çift, diğer iki orbitalde tek ve aynı spinli olarak yerleşmiştir. Spin yönleri I. durumdan farklı olsa da, kurala uygundur. Bu şema da doğrudur.
- III. durum: $1s^2 2s^2 2p^4$ dağılımını gösterir ancak Hund Kuralı'nı ihlal eder. $2p$ orbitallerindeki $4$ elektron, üçüncü $2p$ orbitali boş bırakılarak ilk iki orbitalde çiftlenmiştir. Elektronlar eş enerjili orbitallere önce tek tek yerleşmelidir. Bu şema yanlıştır.
- Doğru Seçenek B'dır.