Zayıf Etkileşimler Kovalent Bağ Polarlık ve Apolarlık Tyt
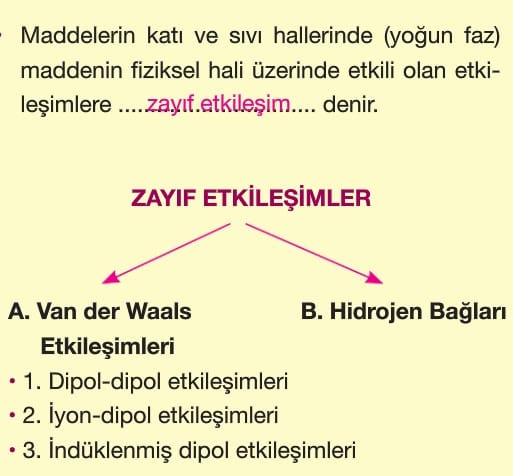
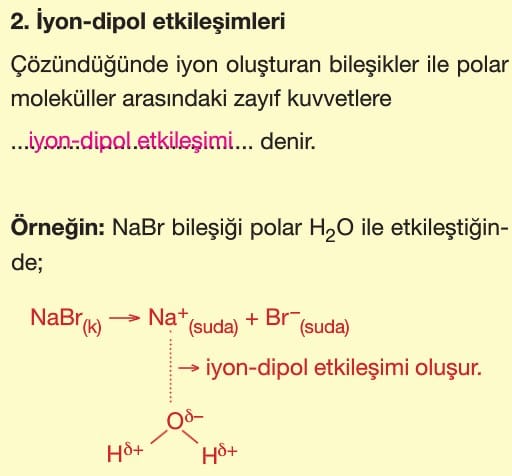
ZAYIF ETKİLEŞİMLER
Kovalent Bağlarda Polarlık ve Apolarlık
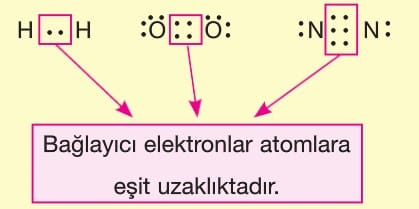
Apolar kovalent bağı oluşturan atomların bağda kullanılan elektronları çekme istekleri aynı olduğu için elektronlar atomlara eşit uzaklıktadır. Dolayısıyla elektron yığılması gerçekleşmediği için kutuplaşma gerçekleşmez. Bu nedenle aynı ametal atomları arasında oluşan bağa apolar kovalent bağ denir.
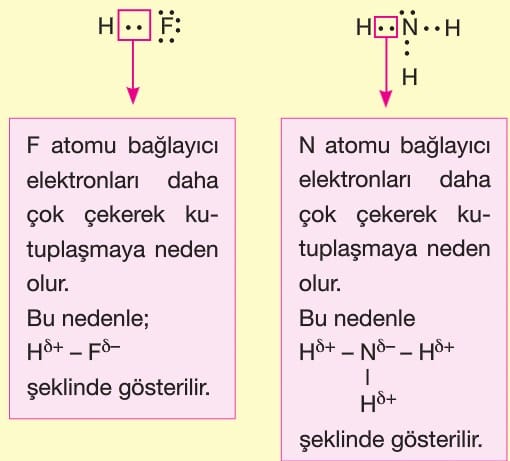
Polar kovalent bağı oluşturan atomların bağda kullanılan elektronları çekme istekleri farklı olduğu için elektronlar atomlara farklı uzaklıktadır. Dolayısıyla elektron yığılması gerçekleştiği için kutuplaşma gerçekleşir. Bu nedenle farklı ametal atomları arasında oluşan bağa polar kovalent bağ denir.
Moleküllerde Polarlık ve Apolarlık
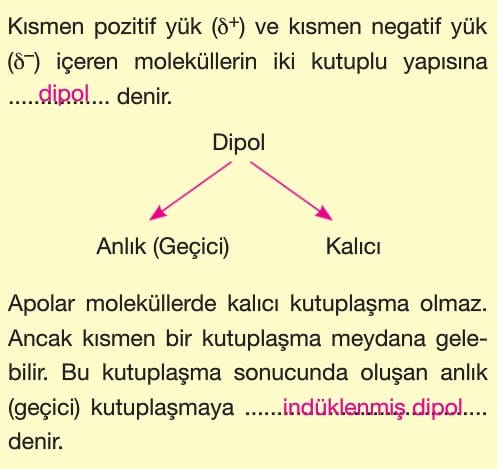
Kovalent bağlı moleküllerde yük dağılımı kutup oluştururken simetrik dağılım gösterebilir.
Simetrik yük dağılımı gösteren moleküllere apolar molekül denir.
Atomları aynı olan moleküllerde, kutuplaşma olmadığı için bu tür moleküller apolar moleküldür.
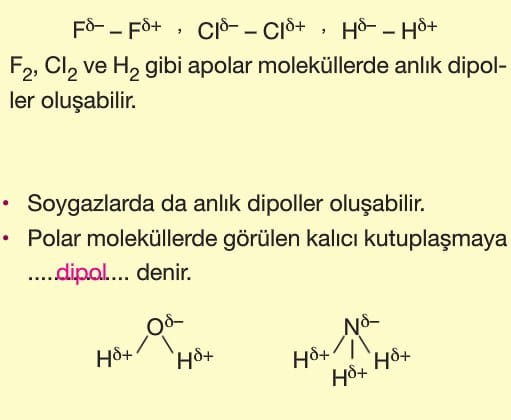
Örneğin: H2 , O2 , N2 , CI2 ve F2 gibi moleküller kutup oluşmadığı için apolar moleküllerdir. Atomları farklı olan moleküllerde de kutuplaşma olmayabilir. Bu nedenle böyle moleküller de apolar moleküldür.
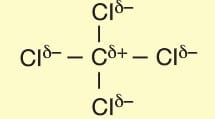
CCI4 molekülünde CI atomları simetrik yük dağılımı konumunda oldukları için molekül apolardır.
Kovalent bağlı moleküllerde yük dağılımı kutup oluşturuyorsa yani simetrik değilse böyle moleküllere polar moleküller denir.
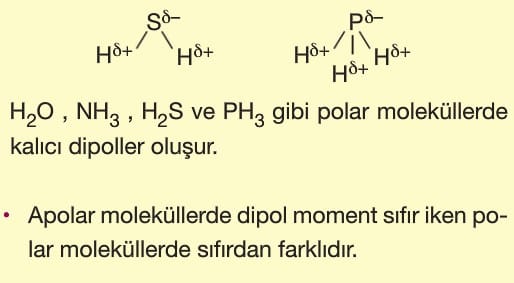
Örneğin: H2O, NH3, HCI, HF, H2S, PH3 ve PCI3 gibi moleküllerin molekül geometrisine bakıldığında polar moleküller oldukları görülür.
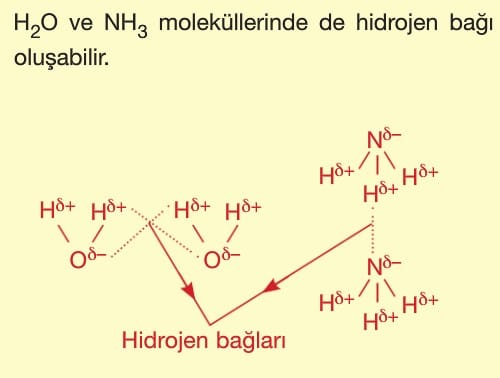
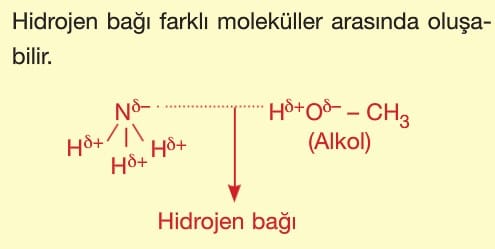
Hidrojen bağı zayıf etkileşimler arasında en güçlü olan bağdır. Bu nedenle bu bağa sahip moleküllerin kaynama noktası yüksektir.
Farklı moleküller arasındaki hidrojen bağı çözünürlüğü artırıcı etki yapar.
Zayıf etkileşimlerin kuvvetlilik sıralaması;
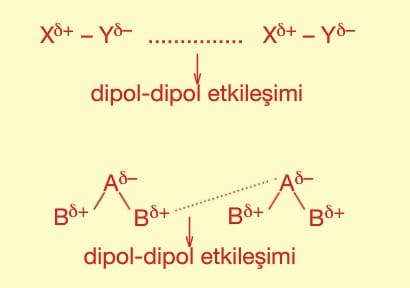
Hidrojen bağı > Dipol—dipol etkileşimleri > London kuvvetleri şeklindedir.