Van der Waals Etkileşimleri 9.Sınıf Kimya
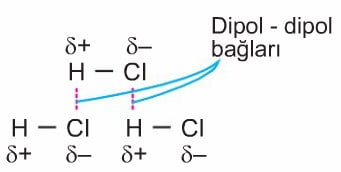
1. Dipol – Dipol etkileşimleri
İki polar molekül birbirine yaklaştığında zıt kutuplarının arasında elektrostatik çekim kuvveti oluşur. Bu şekilde polar moleküller arasında oluşan çekim kuvvetine dipol – dipol bağı denir.
Dipol – dipol bağlarının gücü iyonik ve kovalent bağın gücünün yaklaşık %1`i kadardır.
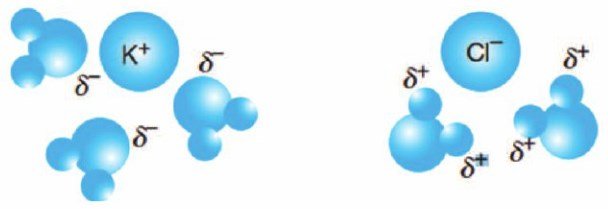
2. İyon – Dipol etkileşimleri
Bir iyonla, polar molekül (kalıcı dipol) arasındaki etkileşime iyon – dipol bağı denir. İyon – dipol bağları, “+” yüklü iyonla polar molekülün “-” kutbu arasında, “-” yüklü iyonla polar molekülün “+” kutbu arasında oluşan çekim kuvvetleridir.
3. İndüklenmiş dipol etkileşimleri
a. İyon – indüklenmiş dipol etkileşimleri
İyonik bir maddenin apolar çözücü içerisinde çözünmesi sonucunda oluşan etkileşimlerdir.
Örneğin KCl’nin benzen (C6H6) içerisinde çözünmesi sonucunda iyon – indüklenmiş dipol etkileşimleri ortaya çıkar.
b. Dipol – indüklenmiş dipol etkileşimleri
Apolar bir molekülün polar çözücü içerisinde çözünmesi sonucunda oluşan etkileşimlerdir. Örneğin iyot katısının (I2) etanol (C2H5OH) içerisinde çözünmesi sonucunda dipol – indüklenmiş dipol etkileşimleri ortaya çıkar.
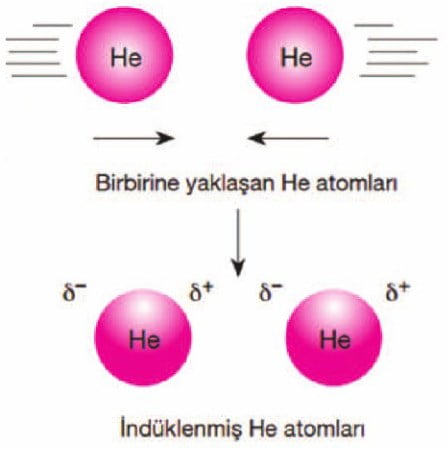
c. London kuvvetleri (İndüklenmiş dipol – İndüklenmiş dipol)
Moleküllerdeki atomların elektronlarının hareketleri sonucunda anlık polarlık oluşur. Bu anlık polarlığa sahip moleküller arasındaki çekim kuvvetlerine London kuvvetleri denir. Soy gazların, H2, Cl2 , O2, CO2 ve CH4 gibi apolar moleküllerin sıvı hâllerinde London kuvetleri görülür. London kuvvetleri diğer van der waals çekim kuvvetlerinden çok daha zayıftır. Bu nedenle bu maddelerin kaynama noktaları düşüktür.
London kuvvetlerinin gücü,
- molekül ağırlığı arttıkça artar.
- temas yüzeyi arttıkça artar.
Çözümlü Örnek Test Soruları
Konu: Van der Waals Etkileşimleri
1. Aşağıdaki etkileşim türlerinden hangisi Van der Waals kuvvetleri arasında yer alır?
A) İyonik bağ
B) Kovalent bağ
C) Dipol-dipol etkileşimi
D) Metalik bağ
E) Hidrojen bağı
Cevap: C
Çözüm: Van der Waals etkileşimleri, moleküller arasında meydana gelen zayıf etkileşimlerdir. Dipol-dipol etkileşimi, London kuvvetleri ve indüklenmiş dipol etkileşimleri bu gruba girer. İyonik, kovalent ve metalik bağlar ise güçlü bağlardır ve Van der Waals etkileşimleri arasında yer almaz. Doğru cevap C şıkkıdır.
2. Aşağıdaki moleküllerden hangisi yalnızca London (Dağılma) kuvvetleri ile etkileşime girer?
A) H₂O
B) NH₃
C) CH₄
D) HCl
E) HF
Cevap: C
Çözüm: London kuvvetleri, apolar (kutupsuz) moleküller arasında görülen en zayıf Van der Waals etkileşimidir. CH₄ (metan) apolar bir moleküldür, bu yüzden yalnızca London kuvvetleri ile etkileşime girer. Diğer moleküller hidrojen bağı veya dipol-dipol etkileşimleri içerebilir. Doğru cevap C şıkkıdır.
3. Van der Waals kuvvetleriyle ilgili aşağıdaki ifadelerden hangisi yanlıştır?
A) Zayıf moleküller arası etkileşimlerdir.
B) London kuvvetleri, tüm atom ve moleküllerde bulunur.
C) Dipol-dipol etkileşimleri sadece apolar moleküller arasında görülür.
D) Van der Waals kuvvetleri, kaynama noktalarını etkileyebilir.
E) Molekülün yüzey alanı arttıkça London kuvvetleri de artar.
Cevap: C
Çözüm: Dipol-dipol etkileşimleri yalnızca polar moleküller arasında gerçekleşir. Apolar moleküllerde dipol-dipol etkileşimi bulunmaz, yalnızca London kuvvetleri görülür. Bu yüzden C şıkkındaki ifade yanlıştır.
4. Aynı sıcaklıkta aşağıdaki maddelerden hangisinin kaynama noktası en düşük olur?
A) H₂S
B) NH₃
C) CH₄
D) H₂O
E) HF
Cevap: C
Çözüm: Kaynama noktası, moleküller arası etkileşimlere bağlıdır.
- H₂O ve HF hidrojen bağı içerdiğinden kaynama noktaları yüksektir.
- H₂S ve NH₃ dipol-dipol etkileşimleri içerir.
- CH₄ (metan) apolar olduğu için yalnızca London kuvvetleri ile etkileşir ve en düşük kaynama noktasına sahiptir.
Bu yüzden doğru cevap C şıkkıdır.
5. London kuvvetlerinin şiddetini etkileyen faktörler arasında aşağıdakilerden hangisi yer almaz?
A) Molekül büyüklüğü
B) Elektron sayısı
C) Molekülün kutupluluk durumu
D) Molekülün yüzey alanı
E) Atomların çekirdek yükü
Cevap: E
Çözüm: London kuvvetleri, elektron bulutunun hareketiyle oluşan anlık dipollerden kaynaklanır.
- Molekül büyüklüğü ve yüzey alanı arttıkça London kuvvetleri artar.
- Elektron sayısı arttıkça geçici dipol oluşumu daha kolay olur.
- Molekülün kutupluluk durumu (polar veya apolar olması), London kuvvetlerinin olup olmamasını değil, diğer etkileşimlerin eklenmesini etkiler.
- Ancak atomların çekirdek yükü (proton sayısı), London kuvvetleri üzerinde doğrudan etkili değildir.
Bu nedenle doğru cevap E şıkkıdır.