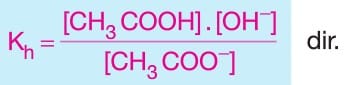Tuzların Asit-Baz Özelliği 11. Sınıf Kimya
- Bazı tuzların sulu çözeltileri asidik ya da bazik olabilir. Bunun nedeni tuzdaki iyonlardan birisinin su ile tepkime vermesi ve sonrasında H+ ya da OH– iyonlarının oluşmasıdır.
- Bu şekilde bir tuzun iyonlarından birisinin su ile tepkime vermesine hidroliz denir.
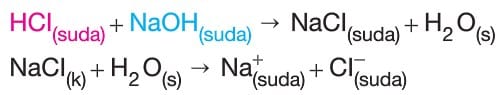
- Kuvvetli asit ve kuvvetli bir bazdan meydana gelen tuz nötr tuzdur ve iyonları sulu ortamda hidroliz olmaz.
- NaCl, KNO3, Bal2, Lİ2SO4 gibi tuzlar nötr tuz sınıfındandır.
- Yukarıdaki denklemlerde HCl kuvvetli asit, NaOH kuvvetli baz olduğundan NaCl nötr tuzdur ve iyonları hidroliz olmaz.
- Zayıf asit ve kuvvetli bazdan oluşan tuzlar bazik tuzdur. Bazik tuzların anyonu sulu ortamda hidroliz olur.
- NaCN, K2CO3, BaF2, CH3COONa gibi tuzlar bazik tuz sınıfındandır.
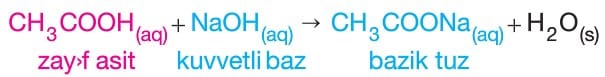
–> Oluşan CH3COONa tuzunun CH3COO– iyonu hidroliz olur.
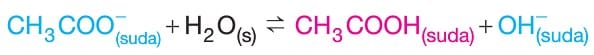
Hidroliz olayı sonucunda çözeltideki OH– iyonu derişimi arttığından dolayı CH3COONa tuzunun sulu çözeltisi baziktir ve çözeltide pH değeri 7 den büyüktür.
Bilgi: CH3COONa tuzu petrol üretiminde, gıdaların korunmasında, tekstilde ve elektroliz ile kaplamacılıkta kullanılır.
- Kuvvetli asit ve zayıf bazdan oluşan tuzlar asidik tuzdur. Asidik tuzların katyonu sulu ortamda hidroliz olur.
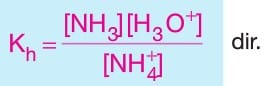
- NH4Cl, Ag2SO4, NH4NO3, Fe(ClO3)3 gibi tuzlar asidik tuz sınıfındandır.
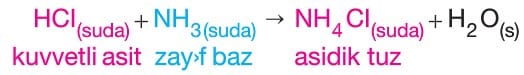
–> Oluşan NH4Cl tuzunun NH4+ iyonu hidroliz olur.
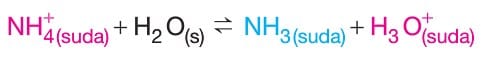
Hidroliz tepkimesi sonucunda çözeltideki [H3O+] derişimi arttığından dolayı NH4Cl tuzunun sulu çözeltisi asidiktir ve çözeltide pH değeri 7 den küçüktür.
- Zayıf asit ve zayıf bazdan oluşan tuzların hem katyonu hem de anyonu hidroliz olur.
- NH4CN, (NH4)2CO3 gibi tuzların hem katyonu hem de anyonu hidroliz olur.
- Asidik tuzlarda çözeltideki H+ iyonları derişimi;
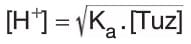
Burada Ksu = Kb . Kh‘dir. Buradaki Kh hidroliz denge sabitidir ve Ka olarak da kullanılır. - Bazik tuzlarda çözeltideki OH* iyonları derişimi;
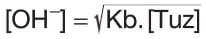
- Burada Ksu = Ka . Kh‘dir. Buradaki Kh hidroliz denge sabitidir ve Kb olarak da kullanılır.
Örnek:
BİR YORUM YAZIN
ZİYARETÇİ YORUMLARI - 0 YORUM