Tepkimelerdeki Entalpi Değişimi Kimya Ayt
ENTALPİ DEĞİŞİMİ
Entalpi
Sabit basınçta sistemin aldığı ya da verdiği ısıya entalpi denir. “H” ile gösterilir. Tepkimelerdeki entalpi değişimine (ΔH) tepkime entalpisi ya da tepkime ısısı denir.
Sabit basınçtaki sistemlerde;
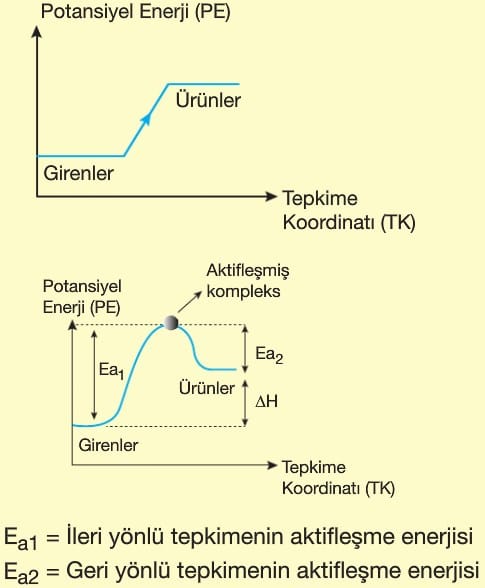
Sistem enerji aldığında entalpi artar ve ΔH > 0 olur.
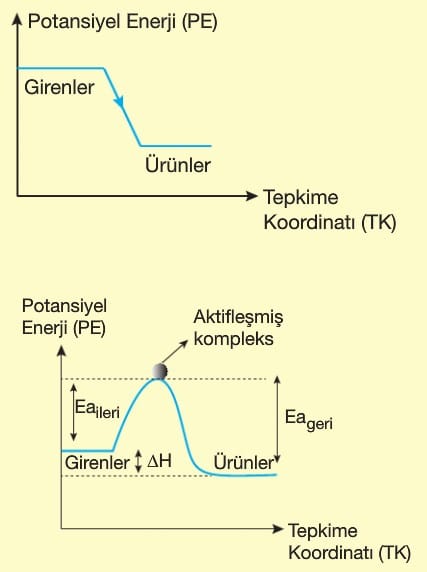
Sistem enerji verdiğinde entalpi azalır ve ΔH < 0 olur.
Sistemin entalpi değişimi ürünlerin entalpileri toplamı ile girenlerin entalpileri toplamı arasındaki farka eşittir.
- Isı alarak gerçekleşen olaylardır.
- Erime, kaynama, süblimleşme ve bazı katıların suda çözünmesi
- Analiz (Ayrıştırma) tepkimeleri
- Bağ kopması
- Elektron kopması
- Elektroliz
- Atomun uyarılması
- Ürünlerin ısı kapsamı, girenlerin ısı kapsamından büyüktür.
- ΔH > O’dır.
- Sistemin iç enerjisi zamanla artar.
- Başlangıçtan sonra kendiliğinden yürümez.
- Tepkimenin devam edebilmesi ve olayın sonlanması için dışarıdan enerji verilmesi gerekir.
- ΔH = Ea1 – Ea2 farkından da hesaplanabilir.
Ekzotermik Olaylar
- lsı vererek gerçekleşen olaylardır.
- Donma, yoğuşma, kırağılaşma, gazların ve bazı katıların suda çözünmesi
- Bağ oluşumu
- Nötr bir atomun elektron alması
- Asit — baz tepkimeleri (nötrleşme)
- Pil tepkimeleri
- Çekirdek tepkimeleri
- Yanma tepkimeleri (Azotun yanması hariç)
- Ürünlerin ısı kapsamı girenlerinkinden küçüktür.
- ΔH < O’dır.
- Sistemin iç enerjisi zamanla azalır.
- Tepkime başladıktan sonra kendiliğinden devam eder.
Tepkime Entalpisine Etki Eden Faktörler
1. Madde Cinsi: Tepkimelerin kendilerine ait bir tepkime entalpisi vardır. Tepkimeye giren ve tepkime sonunda oluşan maddeler değişirse entalpi de değişir.
2. Fiziksel Hâl: Tepkimedeki maddelerin fiziksel hâllerinin değişmesi tepkime entalpisini de değiştirir.
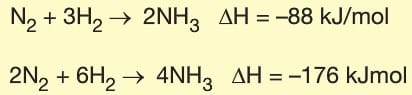
3. Madde Miktarı: Tepkimeye giren ve tepkime sonunda oluşan maddelerin miktarları değişirse tepkime eltalpisi de aynı oranda değişir.
4. Tepkime Koşulları: Tepkimenin gerçekleştiği sıcaklık ve basınç koşullarının değişmesi tepkime entalpisini değiştirir. 25 0C ve 1 atm’de ölçülen tepkime entalpisine standart tepkime entalpisi denir. ΔHo ile gösterilir.
Standart Oluşum Entalpisi: 25 oC ve 1 atm’de 1 mol bileşiğin elementlerinden oluşumu sırasında alınan ya da verilen ısıya denir.
Hess Yasası
Germain Hess tarafından geliştirilen yasaya göre, kimyasal tepkimelerde ürünler genellikle birkaç adımda gerçekleşir. Birden fazla tepkime ile gerçekleşen tepkimelerde ΔH değeri tepkimelerin entalpileri toplamına eşittir.
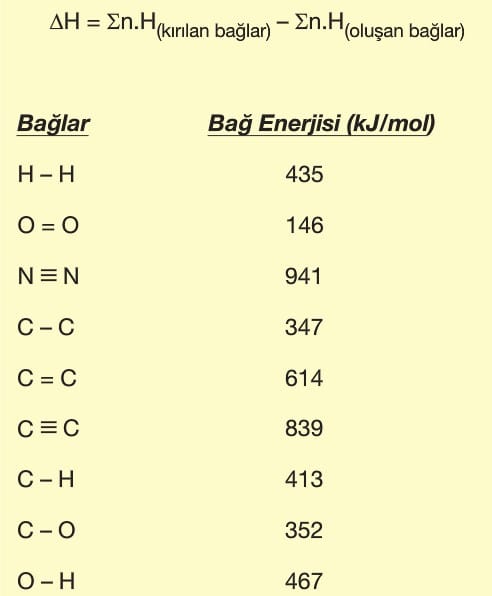
Bağ Enerjileri
İki atom arasındaki kimyasal bağı koparmak için gereken minimum enerjidir. Bağ kırılma entalpisi olarakda adlandırılır. Yani bir kimyasal bağı koparmak için gereken enerji, bağın oluşumu sırasında açığa çıkan enerjiye eşittir.
Kalorimetrik Yöntem ile ΔH’nin Hesaplanması
Fiziksel ve kimyasal tepkimelerde ısı değişimini hesaplamak için kalorimetre kabı kullanılır.
Çözümlü Örnek Test Soruları
1. Aşağıdaki olaylardan hangisi ekzotermik bir tepkimedir?
A) Buzun erimesi
B) Suyun buharlaşması
C) Odunun yanması
D) Tuzun suda çözünmesi
Doğru Cevap: C
Çözüm: Odunun yanması sırasında ısı açığa çıkar. Isı veren yani çevreye ısı aktaran olaylar ekzotermiktir. Bu nedenle doğru cevap C şıkkıdır.
2. Endotermik bir tepkimede aşağıdakilerden hangisi doğrudur?
A) Tepkime sırasında ortam ısınır
B) Ürünlerin toplam entalpisi girenlerden küçüktür
C) ΔH değeri negatiftir
D) Tepkime çevreden ısı alır
Doğru Cevap: D
Çözüm: Endotermik tepkimeler çevreden ısı alır ve bu nedenle ortamın sıcaklığı düşer. ΔH pozitiftir. Bu nedenle doğru cevap D’dir.
3. Aşağıdakilerden hangisi tepkimenin entalpi değişimini etkileyen faktörlerden biri değildir?
A) Maddenin fiziksel hâli
B) Kullanılan katalizör
C) Tepkimeye giren maddelerin miktarı
D) Sıcaklık ve basınç
Doğru Cevap: B
Çözüm: Katalizör tepkimenin hızını etkiler ancak entalpi değişimini (ΔH) etkilemez. Diğer faktörler tepkime ısısını doğrudan etkileyebilir.
4. Aşağıdaki tepkimelerden hangisinin ΔH değeri negatiftir?
A) Fotosentez tepkimesi
B) Buzun erimesi
C) Amonyak sentezi (N₂ + 3H₂ → 2NH₃)
D) Su buharının gaz haline geçmesi
Doğru Cevap: C
Çözüm: Amonyak sentezi ekzotermik bir tepkimedir ve ısı açığa çıkar. Bu yüzden ΔH negatiftir. Diğer olaylar endotermiktir.
5. Bir tepkimede ΔH = +75 kJ verilmiştir. Bu ne anlama gelir?
A) Tepkime 75 kJ ısı verir
B) Tepkime sırasında sıcaklık artar
C) Tepkime çevreden 75 kJ ısı alır
D) Tepkime ekzotermiktir
Doğru Cevap: C
Çözüm: ΔH’nin pozitif olması, tepkimenin endotermik olduğunu ve çevreden ısı aldığını gösterir. Bu nedenle doğru cevap C’dir.

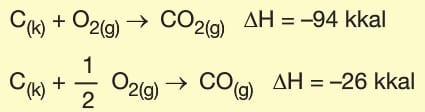
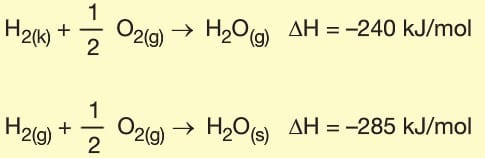



Thank yooo, superr. İşime yaradı btch