Tepkime Isılarının Toplanabilirliği (Hess Yasası) 11. sınıf kimya
Konunun altında ders videoları bulunmaktadır.
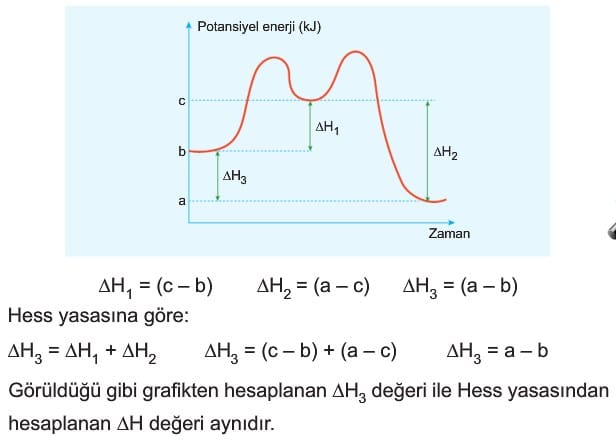
Bazı tepkimeler birden fazla basamakta gerçekleşebilir veya bir tepkime denklemi birden fazla tepkimenin uygun şekilde yazılarak toplanması ile bulunabilir. Bu durumda verilen tepkime entalpilerinden yararlanılarak istenilen tepkimenin entalpisi hesaplanır.
Tepkime ısıları ile ilgili önemli çalışmalar yapan Rus kimyacı G.H. Hess 1840 yılında tepkime ısılarının tepkimenin izlediği yola bağlı olmadığını ispatlamıştır. Eğer bir tepkime iki veya daha fazla tepkimenin toplamı ile bu tepkimelerin entalpi toplamları tepkimenin entalpisine eşittir. Bu kanuna tepkime ısılarının toplanabilirliği veya HESS yasası denir.
Çözümlü Örnek Test Soruları
Tepkime Isılarının Toplanabilirliği (Hess Yasası)
Hess yasası, kimyasal tepkimelerde toplam entalpi değişiminin, ara basamakların entalpi değişimlerinin toplamına eşit olduğunu belirtir. Bu yasa, tepkimenin hangi yol ile gerçekleştiğine bağlı olmaksızın entalpi değişiminin aynı kaldığını söyler ve kompleks tepkimelerin entalpilerini hesaplamak için kullanılır.
1. Aşağıdaki tepkimelerden hangisi Hess yasasının bir uygulaması olarak düşünülebilir?
A) Bir tepkimenin ara basamaklarının entalpi değişimlerinin toplanması ile toplam entalpi değişimi hesaplanır.
B) Tek basamaklı bir tepkimenin entalpi değişimi hesaplanır.
C) Yalnızca endotermik tepkimelerde ısı değişimi hesaplanır.
D) Ürünlerin ve reaktanların bağ enerjileri karşılaştırılarak hesaplanır.
Çözüm: Hess yasası, ara basamakların entalpi değişimlerinin toplanmasıyla toplam entalpi değişiminin hesaplanmasına olanak tanır. Cevap A.
2. Bir kimyasal tepkimenin entalpi değişimi, iki basamaktan oluşan şu şekilde verilmiştir:
Tepkime 1: A + B → C (ΔH₁ = -100 kJ)
Tepkime 2: C → D (ΔH₂ = +50 kJ)
Buna göre, A + B → D tepkimesinin entalpi değişimi kaç kJ’dür?
A) -150 kJ
B) -50 kJ
C) 0 kJ
D) -100 kJ
Çözüm: Hess yasasına göre, iki basamağın entalpi değişimleri toplanarak A + B → D tepkimesinin entalpi değişimi hesaplanır: ΔH = ΔH₁ + ΔH₂ = -100 kJ + 50 kJ = -50 kJ. Cevap B.
3. Aşağıda verilen tepkimelerden hangisinin entalpi değişimi Hess yasası kullanılarak hesaplanamaz?
A) H₂ + 1/2 O₂ → H₂O (ΔH = -286 kJ/mol)
B) C + O₂ → CO₂ (ΔH = -393,5 kJ/mol)
C) N₂ + O₂ → 2 NO (ΔH = +180 kJ/mol)
D) CO + 1/2 O₂ → CO₂ (ΔH = -283 kJ/mol)
Çözüm: Tüm tepkimeler, entalpi değişimleri bilindiği için Hess yasası ile hesaplanabilir. Ancak tek basamaklı tepkimeler için Hess yasası gereksizdir. Cevap A.
4. Hess yasası kullanılarak toplam entalpi değişimi hesaplanan bir tepkimede, ara basamakların entalpi değişimleri toplandığında toplam entalpi değişimi 0 kJ olarak hesaplanmıştır. Bu durum hangi anlamı taşır?
A) Tepkime ekzotermiktir ve ısı açığa çıkar.
B) Tepkime endotermiktir ve ısı soğurulur.
C) Tepkimenin toplam entalpi değişimi yoktur.
D) Tepkime denge halindedir ve ısı değişimi gözlenmez.
Çözüm: Eğer Hess yasası ile hesaplanan toplam entalpi değişimi 0 kJ ise, bu tepkimenin entalpi değişiminin olmadığı ve sistemin denge durumunda olduğu anlamına gelir. Cevap C.
5. Hess yasası kullanılarak aşağıdaki tepkimenin entalpi değişimini hesaplayınız:
Tepkime 1: N₂ + O₂ → 2 NO (ΔH₁ = +180 kJ)
Tepkime 2: 2 NO + O₂ → 2 NO₂ (ΔH₂ = -114 kJ)
Buna göre, N₂ + 2 O₂ → 2 NO₂ tepkimesinin entalpi değişimi kaç kJ’dür?
A) +66 kJ
B) -294 kJ
C) +294 kJ
D) +66 kJ
Çözüm: Hess yasasına göre, ara basamakların entalpi değişimleri toplanarak toplam entalpi değişimi bulunur: ΔH = ΔH₁ + ΔH₂ = +180 kJ – 114 kJ = +66 kJ. Cevap A.
6. Bir tepkimenin entalpi değişimi doğrudan ölçülemiyorsa, Hess yasası kullanılarak nasıl bir yöntem izlenir?
A) Tepkime basamaklara bölünür ve her bir basamağın entalpi değişimi toplanır.
B) Tepkime tek bir adımda hesaplanır.
C) Sadece ürünlerin entalpileri kullanılır.
D) Tepkime sırasında sıcaklık ölçümü yapılır.
Çözüm: Hess yasası, bir tepkimenin basamaklara bölünerek her basamağın entalpi değişiminin toplanması ile toplam entalpi değişiminin hesaplanmasını sağlar. Cevap A.