Tepkime Hızına Etki Eden Faktörler Kimya Ayt
Tepkime Hızına Etki Eden Faktörler
1. Madde Cinsi:
- Kimyasal tepkimeler, tepkimeye giren maddelerin türüne bağlı olarak yavaş ya da hızlı gerçekleşebilir.
- Oluşan ve kopan bağ sayısı arttıkça tepkime daha yavaş gerçekleşir.
- Yüklü taneciklerin tepkimeleri bağ yapısı ve bağ sayısının değiştiği tepkimelere göre hızlı olarak gerçekleşir. En hızlı gerçekleşen tepkimeler zıt yüklü iyon tepkimeleridir.
- Demirin paslanması, protein ve yağların sindirimi, karbonhidratların hidrolizi, petrol ve kömür oluşumu yavaş gerçekleşen tepkimelerdir.
- Doğalgaz ve kömür yanması, asitlerle bazların etkileşimi, zıt yüklü iyonların suda birleşerek çökmesi, grizu patlaması ve araba yastıkların açılmasına neden olan tepkimeler hızlı tepkimelerdir.
2. Derişim:
Kimyasal bir tepkimede, reaktitlerin derişiminin artması tepkime hızını artırır. Tepkime hızı, birim zamanda gerçekleşen etkin çarpışma sayısına bağlıdır. Tepkimeye girenlerin birim hacimdeki tanecik sayısı arttığında çarpışma olasılığı da artar. Bu durum deneysel olarak saptanmıştır.
Hız bağıntısı yazılırken;
- Bağıntıya gazların ve suda çözünmüş maddelerin derişimleri yazılır. Katı ve sıvıların derişimleri değişmediğinden formülde yer almazlar.
- Bağıntıya yazılan maddelerin tepkime denklemindeki katsayıları bağıntıda üs olarak yazılır. Üsler toplamı da tepkime hız denkleminin derecesini verir.
- III. Bağıntıya yazılan madde derişimleri hız sabiti (k) ile çarpılır.
- Tek basamakta gerçekleşen tepkimelerin hız bağıntısı yazılırken tepkime denklemi göz önüne alınır.
- Mekanizmalı tepkimelerde tepkimenin hız bağıntısı yavaş basamağa göre yazılır.
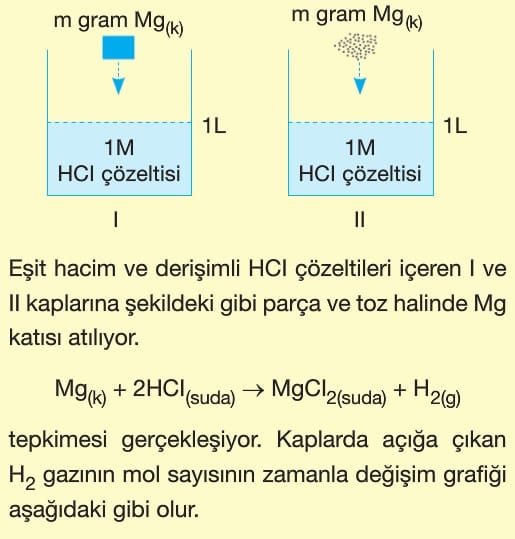
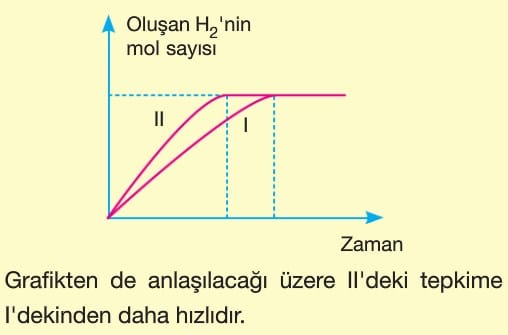
3. Temas Yüzeyi:
Tepkimeye giren maddelerin temas yüzeyleri artırılırsa çarpışma olasılığı artacağı için tepkime hızı da artar.
Toz şekerin aynı miktardaki küp şekere göre daha hızlı çözünmesi bu duruma örnektir.
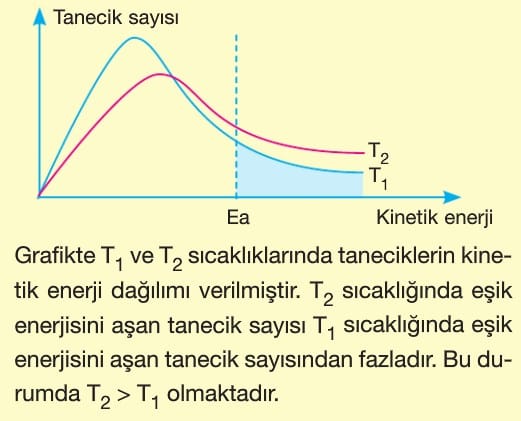
4. Sıcaklık:
- Sıcaklık artırıldığında tepkime hızı da artar. Tepkime hızındaki artışın nedeni iki şekilde açıklanabilir.
- I. Sıcaklık artırıldığında taneciklerin hızı da artacağından birim zamandaki etkin çarpışma sayısı artar.
- II. Sıcaklık artırıldığında aktifleşme (eşik) enerjisini aşan tanecik sayısı artar.
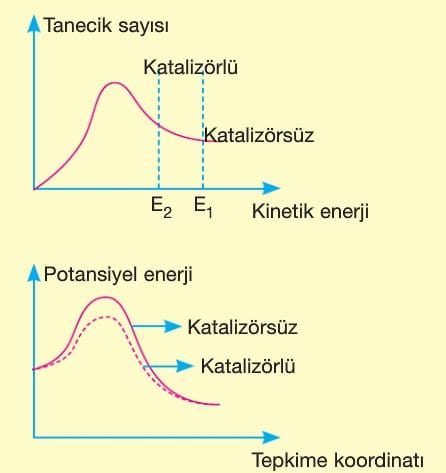
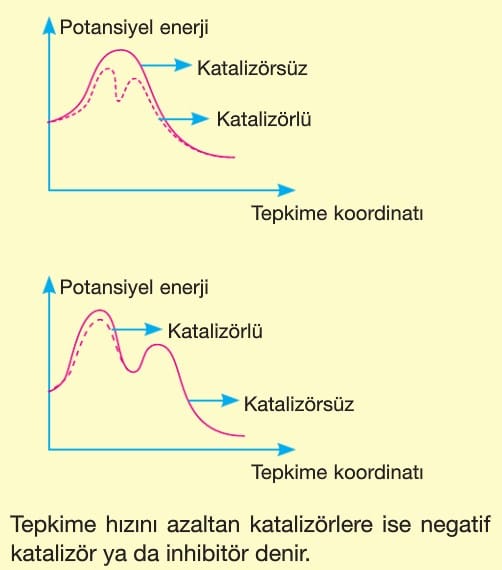
5. Katalizör:
Tepkimeye dışarıdan eklenen ve tepkime sonunda değişmeden çıkan maddelerdir.
Tepkimenin eşik enerjisi düşürerek tepkime hızının artmasına neden olur.
Tepkimenin başlaması için gerekli değildir. Başlamış bir tepkimeyi durduramazlar.
Tepkimenin yönünü değiştirmez, ama tepkimenin gidiş yolunu değiştirir. Yani mekanizmayı değiştirirler.
Tepkime entalpisini (AH) değiştirmez.
Hız sabitinin (k) artmasına neden olur.
Aktifleşmiş kompleksin türünü değiştirip enerjisini azaltır.
Tepkimeye girenlerle aynı fiziksel halde olanlara homojen katalizör denir.
Ürünlerin cinsini, miktarını ve tepkimenin verimini değiştirmez.
Her tepkimenin kendine göre bir katalizörü vardır.
Tepkime ok işareti üzerinde yazılabilirler.
Katalizör kullanıldığında potansiyel enerji-tepkime koordinatı ve tanecik sayısı-kinetik enerji grafiklerindeki değişimi aşağıdaki gibi olur.
6. Basınç ve Hacim:
Sabit sıcaklıkta sabit hacimli kaplara gaz eklenmesi basıncı ve derişimi artırır. Derişimin artması etkin çarpışma sayısını artıracağından tepkime hızı da artar.
Sabit sıcaklıkta pistonlu kaplarda pistonun sıkıştırılarak basıncın artırılması derişimin artmasına neden olur. Bu da tepkime hızının artmasına neden olur.
Sulu çözeltilerde ortama su ilave edilmesi hacmin artmasına ve derişimin azalmasına neden olur. Bu durum etkin çarpışma sayısını ve tepkime hızını azaltır.
Molekülerite:
- Tepkimeye giren molekül sayısına molekülerite denir.
- Moleküleritede fiziksel haller önemsizdir.
- Mekanizmalı tepkimelerde molekülerite net tepkimeden bulunur.
1 molekül varsa monomoleküller ya da unimoleküler
2 molekül varsa bimoleküler
3 molekül varsa trimoleküler tepkime denir.