Tepkime Hızı Ölçülmesi Kimya Ayt
TEPKİME HIZI
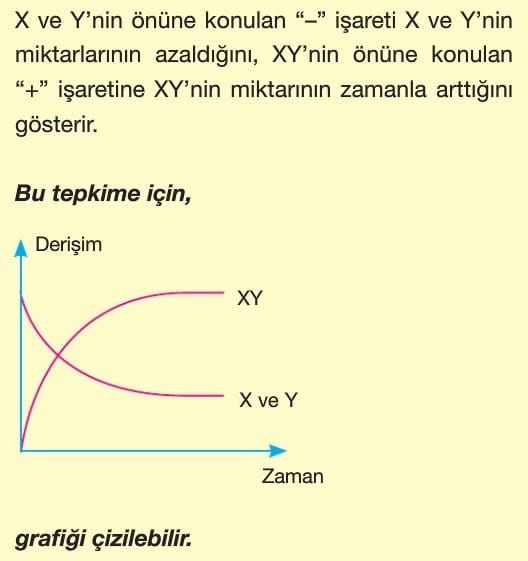
Kimyasal tepkimelerde maddelerin miktarları tepkime tamamlanıncaya kadar sürekli olarak değişir. Tepkime sürecince reaktiflerin miktarları azalırken, ürünlerin miktarları artar.
Tepkime hızı, birim zamanda (saat, dakika, saniye) harcanan ya da oluşan madde miktarıdır. Tepkime hızında değişen madde miktarı genellikle derişim (molarite) olarak hesaplanır.
Anlık Hız:
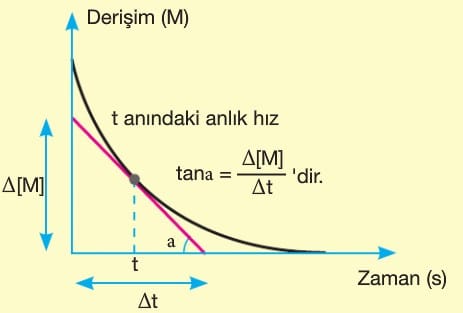
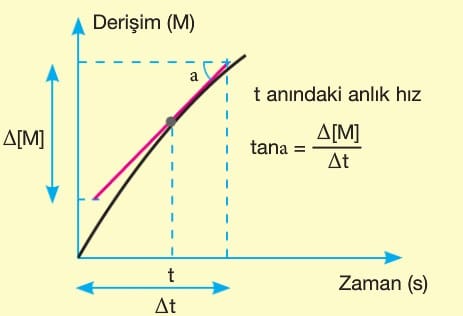
Bir tepkimedeki maddelerin (reaktiflerin ya da ürünlerin) belirli bir andaki hızıdır.
Derişim – zaman grafiğinde belirli bir anda (t anında) çizilen teğetin eğimi (tana) anlık hızı verir. Derişim azalan grafik girenlerdeki bir maddeye, derişimi artan grafik ise ürünlerdeki bir maddeye aittir.
Tepkime Hızının Ölçülmesi:
Tepkime hızının ölçülmesinde maddelerin derişimlerindeki değişikliğin yanında tepkimeye uygun bir özellik (renk, iletkenlik, basınç, hacim) kullanılabilir.
1. Renk Değişimi
Tepkimede renkli bir madde harcanıyor ya da oluşuyorsa, renk değişimi tepkime hızının ölçülmesinde kullanılabilir.
2. İletkenlik Değişimi
Sulu ortamda iyonlar arasındaki tepkimelerde iyonların derişimine bağlı olarak ortamın iletkenliği de değişir.
Saf su kovalent bağlı bir bileşik olduğundan elektriği çok az iletir. Ancak su içerisinde NaCI katısı çözülürse;
3. Basınç ve Hacim Değişimi
Gaz fazında maddelerin bulunduğu tepkimelerde mol sayısındaki değişim ile doğru orantılı olarak gaz basıncı da değişir.
Sabit basınç ve sıcaklık koşullarında gaz fazında gerçekleşen tepkimelerde mol sayısındaki değişim ile doğru orantılı olarak hacim de değişir.
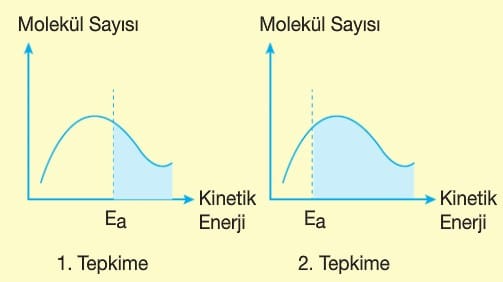
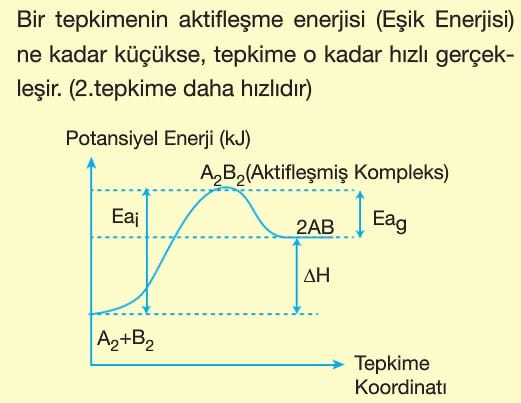
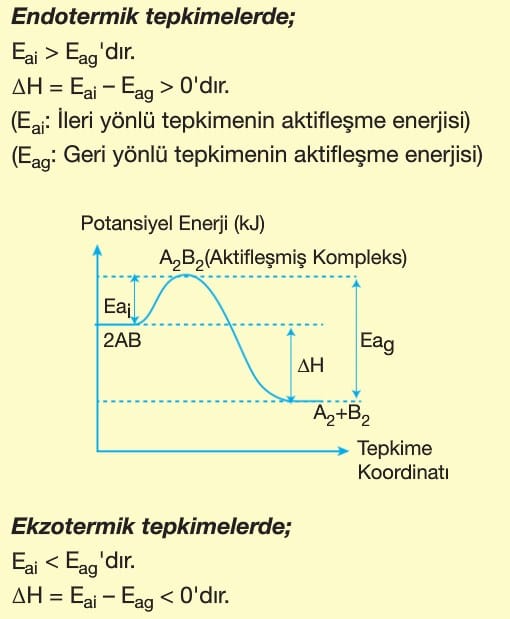
Kimyasal bir tepkimenin gerçekleşebilmesi için bazı koşulların uygun olması gerekir.
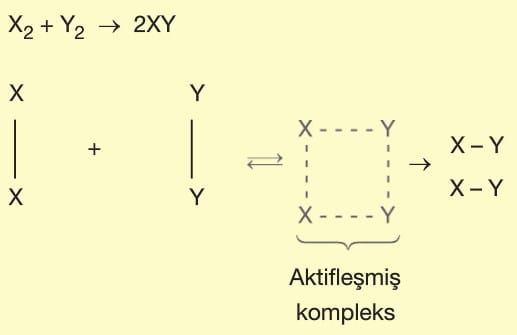
1. Bir tepkimenin gerçekleşmesi için taneciklerin çarpışması (etkin çarpışma) gerekir. Bu çarpışmalar esnek olmayan yani yüksek enerjili çarpışmalardır.
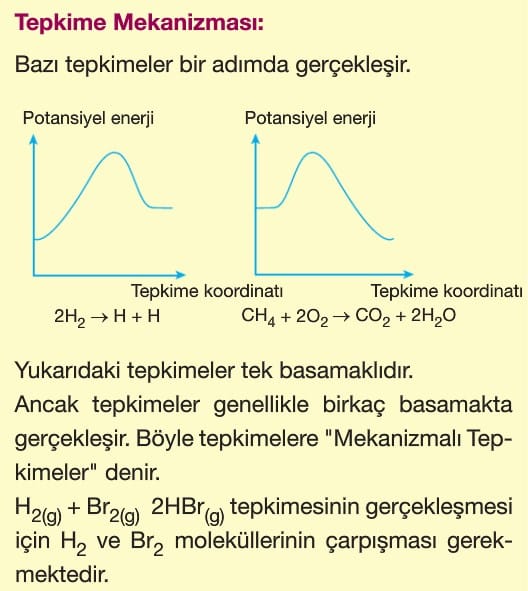
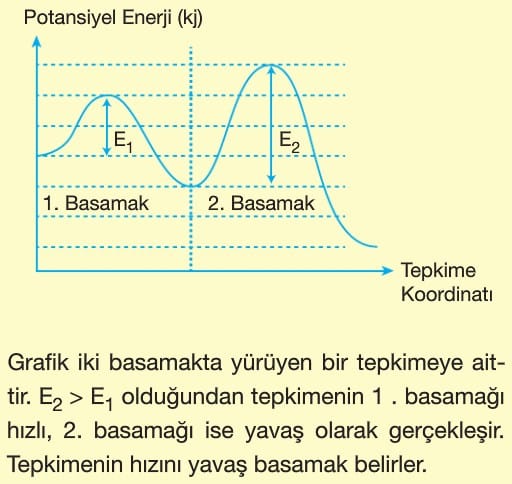
Mekanizmalı tepkimelerde basamaklardan birisinde oluşup, diğerinde tüketilen maddeye ara ürün denir. Tepkimeye katılan, ancak tepkime sonunda değişmeden çıkan maddeye katalizör denir. Katalizör tepkime hızını artıran bir maddedir.