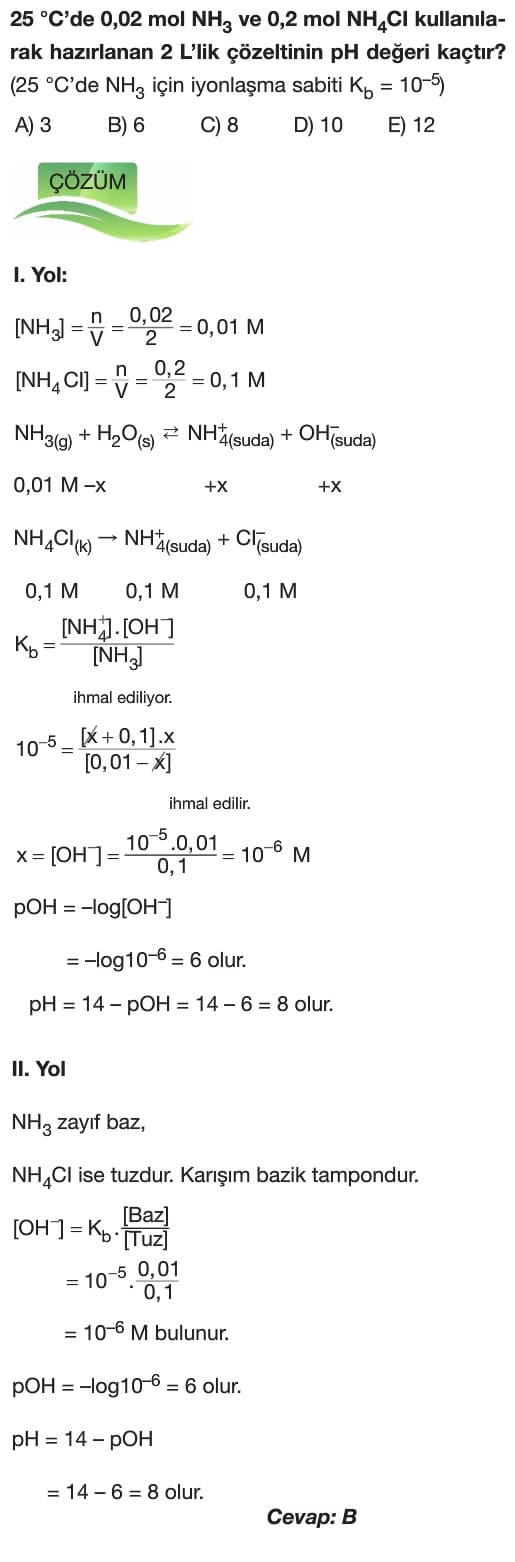
Tampon Çözeltiler 11. sınıf kimya
Tampon çözeltiler, 11. sınıf kimya konularında, pH dengesini koruma yeteneği ile öne çıkan önemli sistemlerdir. Bu çözeltiler, içerdiği zayıf asit ve onun eşlenik bazından ya da zayıf baz ve onun eşlenik asidinden oluşur. Dışarıdan eklenen asit veya baz miktarlarına karşı pH değişimini minimize ederek, biyolojik sistemlerde ve laboratuvar deneylerinde kararlı bir ortam sağlarlar. Bu özellikleri nedeniyle tampon çözeltiler, biyokimya, ilaç sanayi ve çevre bilimlerinde yaygın olarak kullanılır ve kimyanın temel konularından biri olarak öğrencilere sunulur.
11. sınıf Tampon Çözeltiler Ders Notu
- Kimyada belli pH değerlerinde çözelti hazırlamak ve bunu uzun süre kullanmak önemlidir. Ancak bu tür çözeltileri saklamak hazırlamaktan daha zordur.
- Kuvvetli asit ya da baz çözeltileri havadaki gazlardan ya da bulundukları kaplardan kolaylıkla etkilenirler. Bundan dolayı laboratuvarlarda daha çok tampon çözeltiler kullanılır.
- Seyreltme ya da az miktarlarda kuvvetli asit ya da kuvvetli baz ilave edilince pH değeri değişmeyen çözeltilere tampon çözelti denir.
- Dengedeki asit ya da baz çözeltilerinde iyonlardan birisinin derişimi artırılırsa denge artan iyon derişimini azaltmak için tepkimeye girenler yönünde kayar. Bu şekilde iyonlaşmanın geriye dönmesine ortak iyon etkisi (tamponlama) denir.
- Zayıf asit ve ortak iyon içeren bir tuz çözeltisinin karışımına asidik tampon denir.
- Zayıf baz ve ortak iyon içeren bir tuz çözeltisinin karışımına bazik tampon denir.
- CH3COOH ve CH3COONa’dan oluşan bir karışımda zayıf asit ve ortak iyon içeren bir tuz çözeltisi kullanıldığından asidik tampon oluşmuştur.
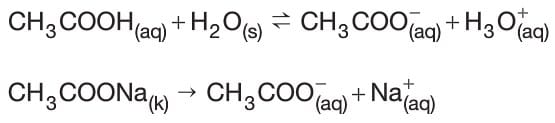
tepkimeleri gerçekleşirken ortama az bir miktar asit eklendiğinde asitten gelen H+ iyonları tampon çözeltide bulunan eşlenik baz CH3COO– iyonları tarafından tüketilir.
![]()
eğer tampon çözeltiye az bir miktar baz eklenirse bazdan gelen OH– iyonları tampon çözeltide bulunan asit tarafından nötralleştirilir.
![]()
- Sorular zayıf asit ya da zayıf bazın iyonlaşma denge bağıntılarından çözülür.
- Ortak iyondan gelen derişim iyonlaşma denge bağıntısında toplam olarak yazılır.
- Çözünürlükten gelen derişimler, toplama ve çıkarma işlemlerinde çok küçük olduğu için ihmal edilir.
- Asidik ya da bazik tampon karışımlarında H+ ya da OH– iyonları derişimleri aşağıdaki formüllerle de hesaplanabilir.

- Tampon çözeltiler nötrleşme tepkimesi verdiklerinde yapılarındaki asit ya da baz bileşenleri tamamen tükenmez. Aksi halde karışımın pH değeri aşırı değişeceğinden tampon çözelti görevini yerine getiremez.
- Tampon çözeltilere günlük hayatımızda birçok alanda rastlayabiliriz:
–> Protein ile ilgili çalışmalar tamponlanmış ortamlarda yapılır. Çünkü protein moleküllerinin yapısı ve üzerlerindeki yüklerin türü ve miktarı ortamın pH’sine bağlıdır.
–> Vücutta katalizör görevi yapan enzimler birer proteindir ve enzimlerin etkin olduğu pH aralığı 6-8 arasıdır. Bundan dolayı laboratuvarlarda yapılan enzim etkinliği çalışmalarında genellikle bu aralığa tamponlanmış ortamlar kullanılır.
–> Bira üretiminin ilk basamağında proteaz ve peptidaz enzimlerinin arpadaki proteinleri hidrolizleyebilmeleri için çözelti pH sinin 5,0 – 5,2 arasında olması gerekir.
–> Vücuttaki tampon sistemlerinden en önemlisi kandır. Kanın normal pH değeri 7,4’tür. Bundan dolayı herhangi bir acil müdahale sırasında vücuda enjekte edilecek sıvılar (serum vb.) kan pH’sini belirli aralıkta tutabilecek tampon içermelidir.