Sulu Çözelti Dengeleri 11. sınıf kimya
- Suyun Oto-iyonizasyonu
- Asit ve Bazların Kuvveti
- Kuvvetli ve Zayıf Asit Bazların Ph Değeri
- Asit ve Bazların Ayrışma Dengesi
- Tampon Çözeltiler
- Kuvvetli Asit-Baz Titrasyonu
- Tuzların Asit-Baz Özelliği
- Çözünme – Çökelme Tepkimeleri
Suyun Otoiyonizasyonu (Otoprotoliz)
Çözümlü Sorular
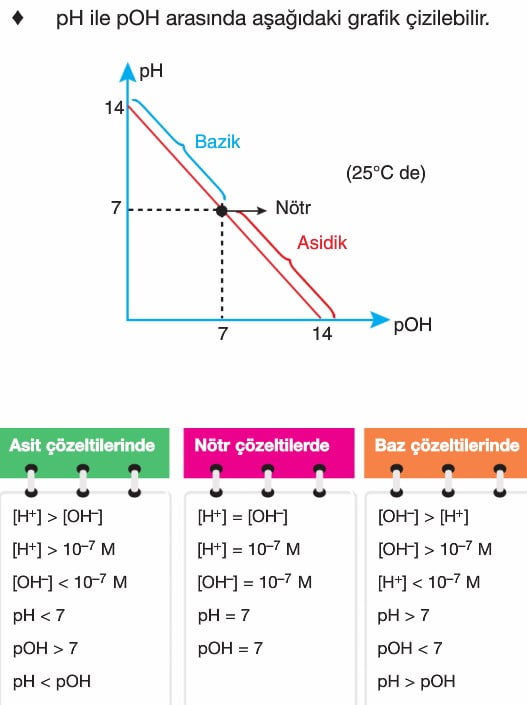
Ph ve pOH Kavramları
Çözümlü Sorular
Asit ve Baz Tanımları
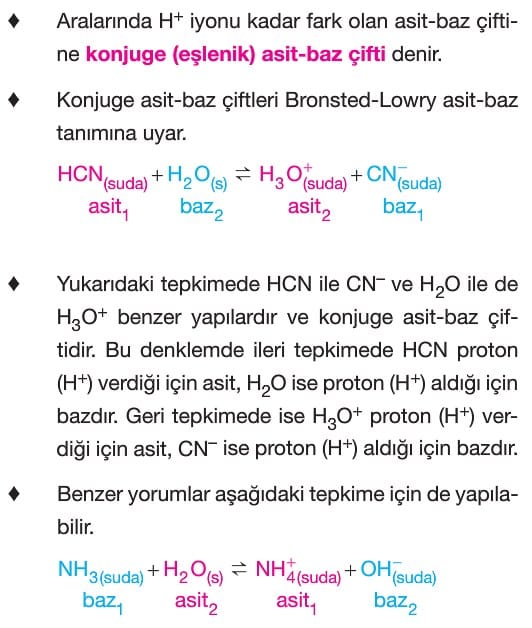
Konjuge (Eşlenik) Asit-Baz Çifti
Çözümlü Sorular
Asitler ve Özellikleri
Çözümlü Sorular
Bazlar ve Özellikleri
Çözümlü Sorular
Asitlik ve Bazlık Gücü
Çözümlü Sorular
Kuvvetli Asit ve Baz Çözeltilerinde Ph ve pOH İşlemleri
Çözümlü Sorular
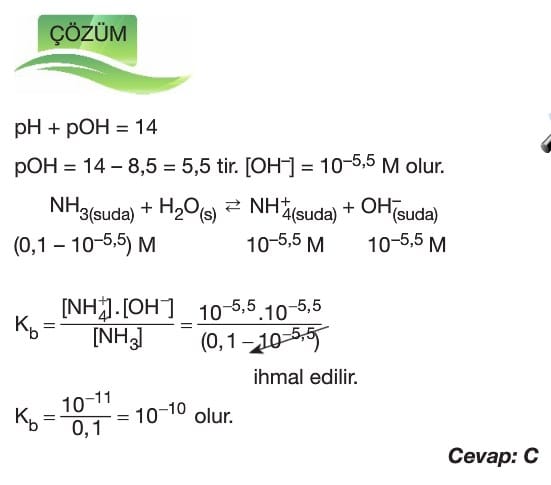
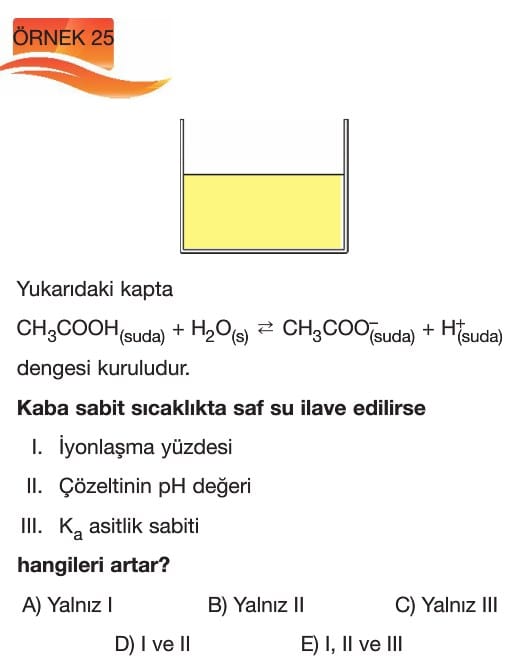
Zayıf Asit ve Baz Çözeltilerinde Ph ve pOH İşlemleri
Çözümlü Sorular
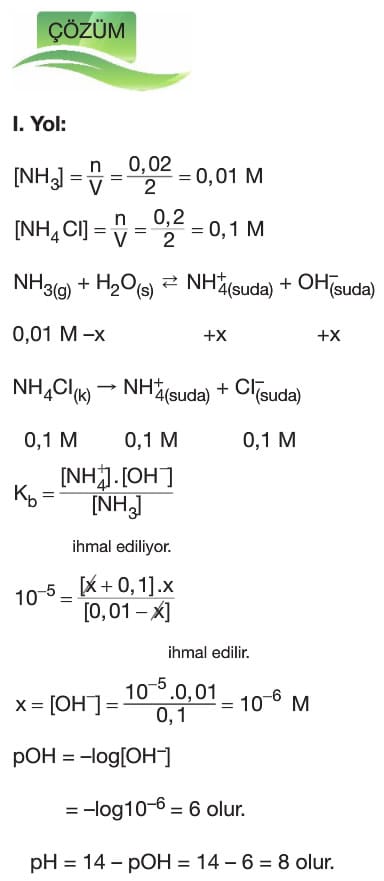
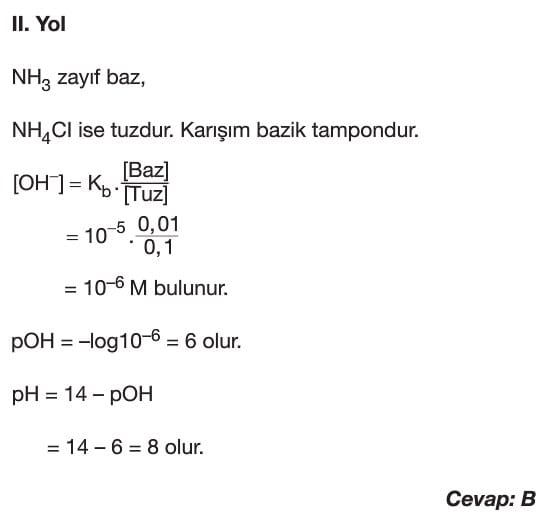
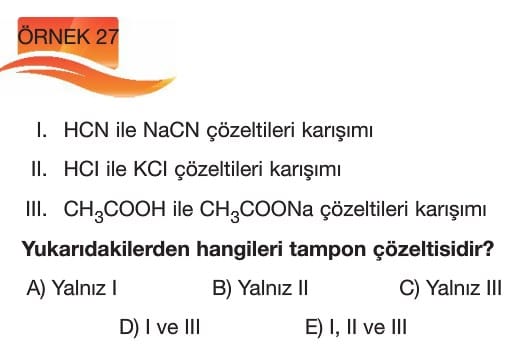
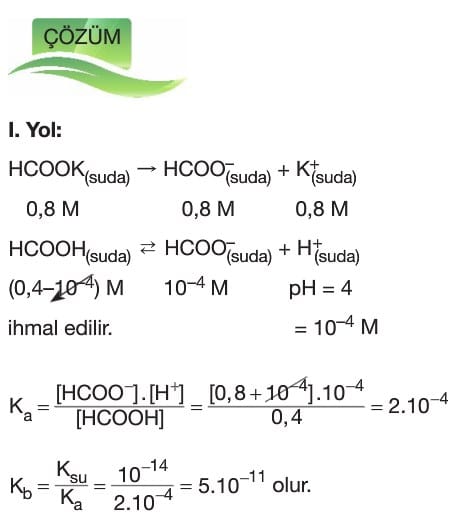
Tampon Çözeltiler
Çözümlü Sorular
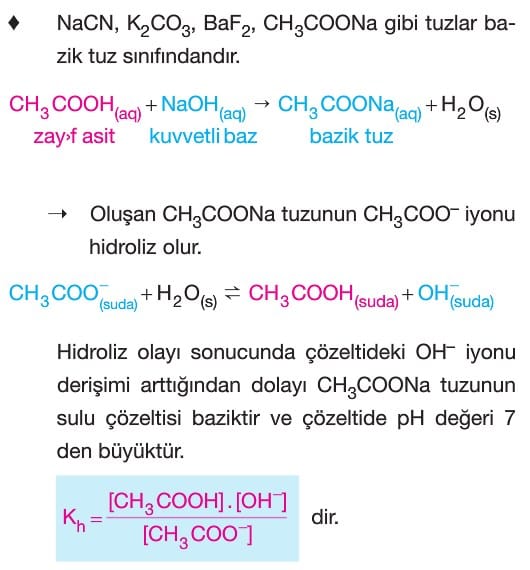
Tuz Çözeltilerinde Asitlik ve Bazlık (Hidroliz)
Çözümlü Sorular
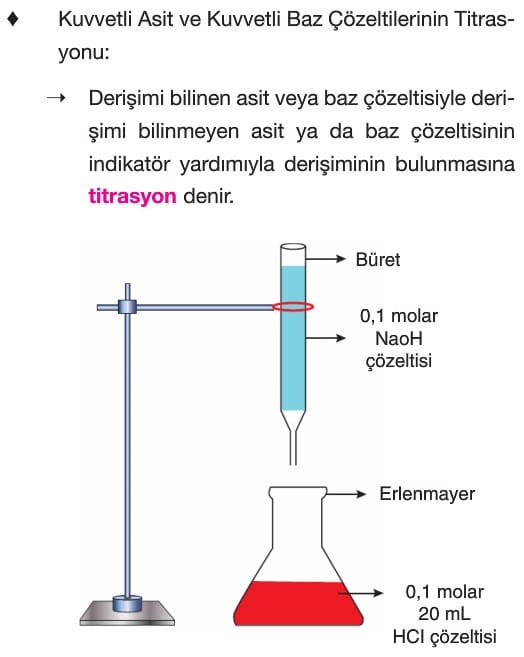
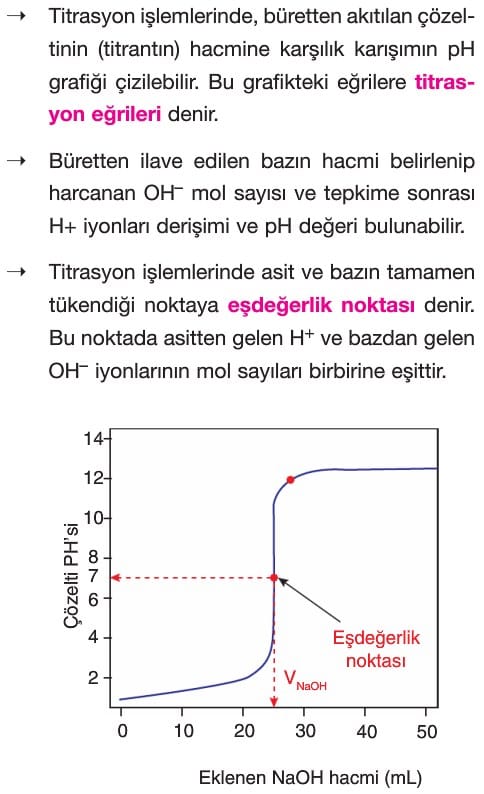
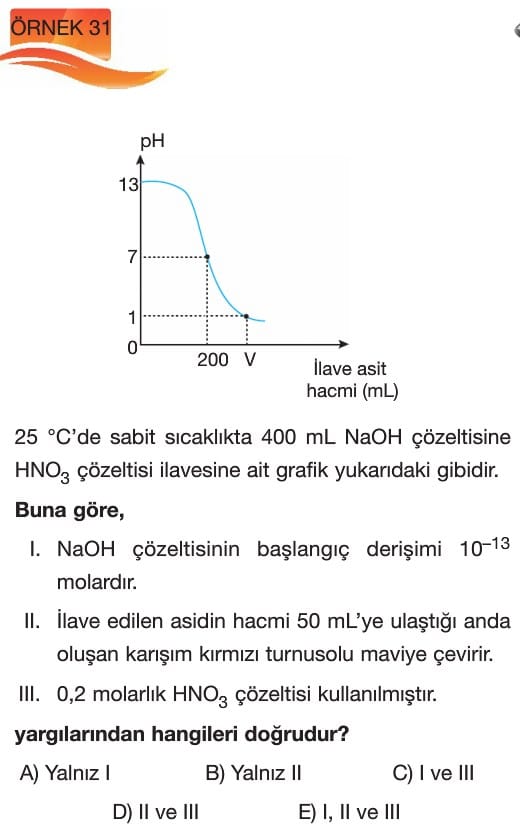
Titrasyon
Çözümlü Sorular
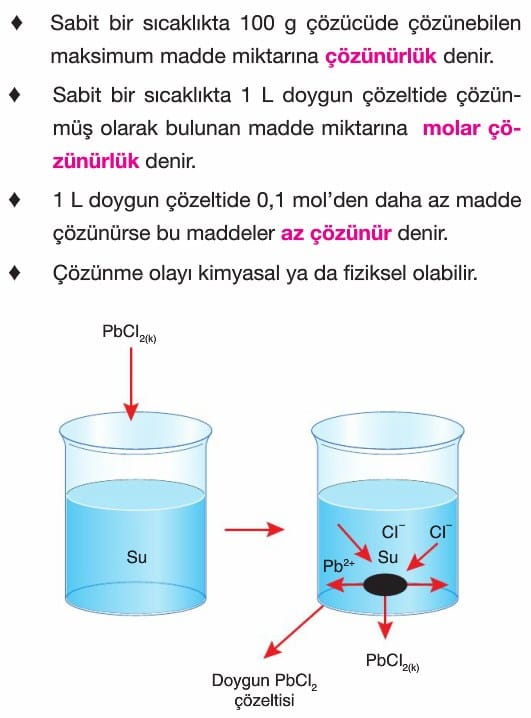
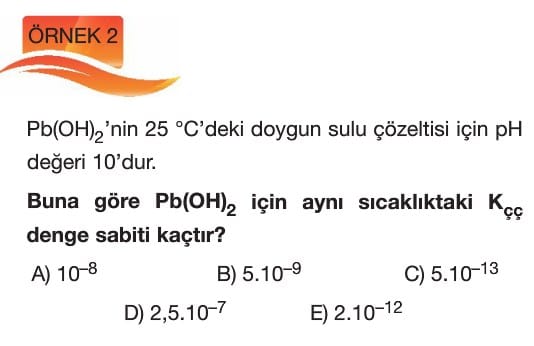
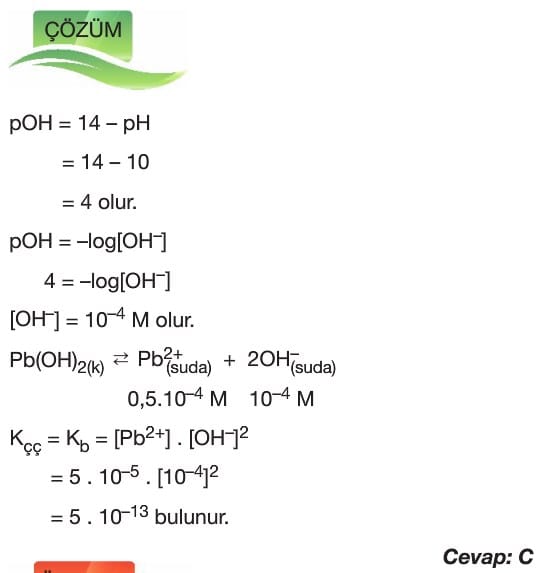
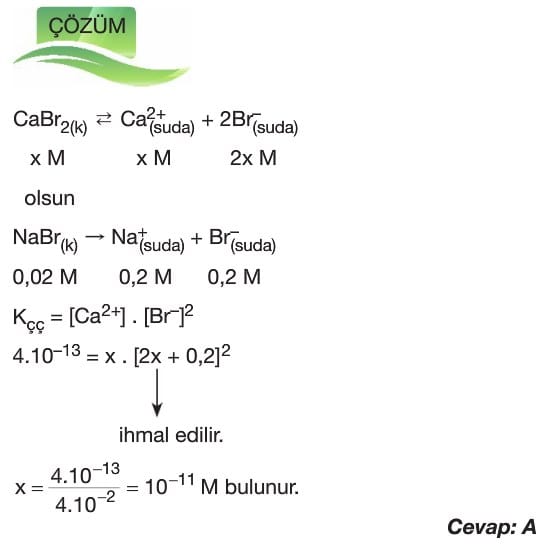
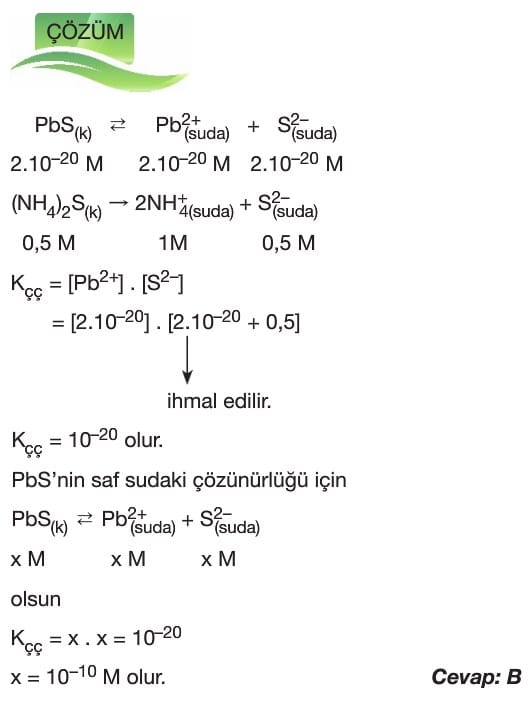
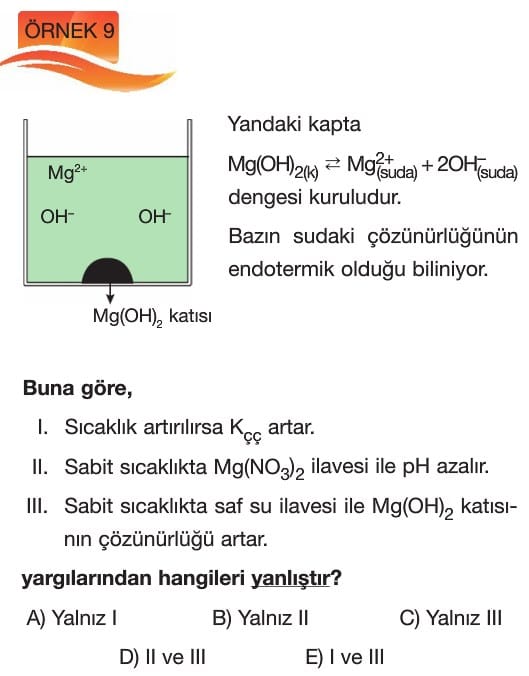
Çözünme – Çökelme Tepkimeleri
Çözümlü Sorular
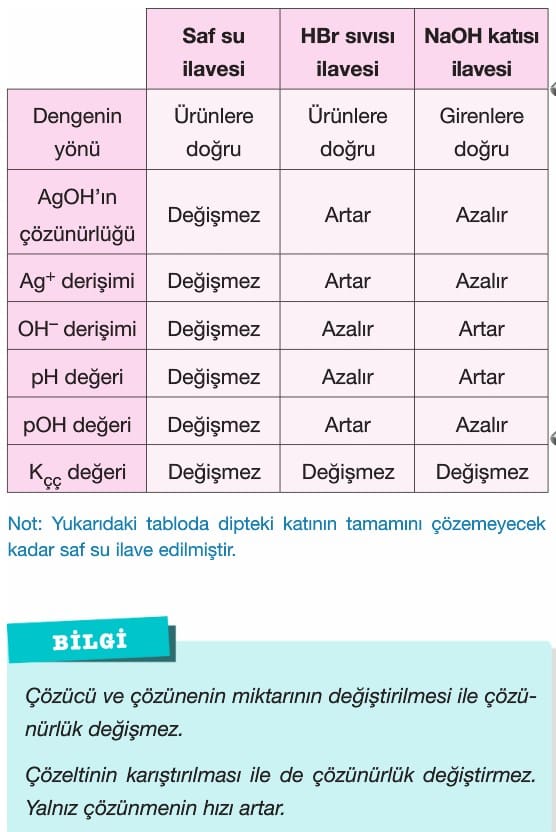
Çözünürlüğe Etki Eden Faktörler

Çözümlü Sorular
Çözümlü Örnek Test Soruları
Sulu Çözelti Dengeleri
Sulu çözelti dengeleri, asit-baz dengeleri, çözünürlük dengeleri ve tampon çözeltiler gibi konuları içerir. Bu denge sistemlerinde, iyonlar arasında gerçekleşen denge tepkimeleri önemli rol oynar ve bu tepkimelerde pH, pOH gibi kavramlar sıkça kullanılır.
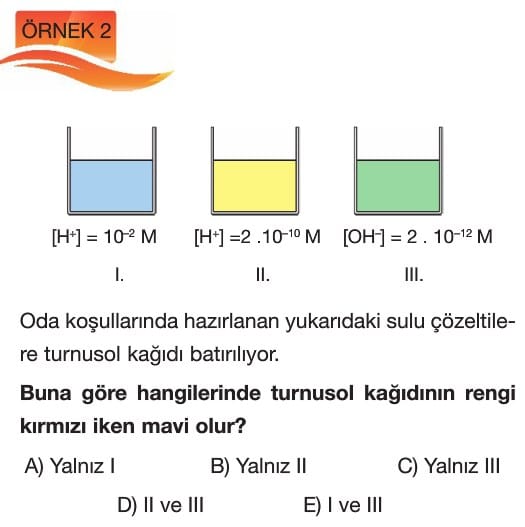
1. Aşağıdaki çözeltilerden hangisi nötr pH değerine sahip bir sulu çözelti örneğidir?
A) HCl çözeltisi
B) NaOH çözeltisi
C) Saf su
D) CH3COOH çözeltisi
Çözüm: Saf su, pH = 7 olan nötr bir çözeltidir. Cevap C.
2. Bir çözeltiye asit eklendiğinde pH değeri nasıl değişir?
A) pH artar.
B) pH azalır.
C) pH sabit kalır.
D) pH değişmez, sadece pOH artar.
Çözüm: Bir çözeltiye asit eklendiğinde H⁺ iyonları artar, bu da pH değerinin azalmasına neden olur. Cevap B.
3. Aşağıdaki çözeltilerden hangisinin pH değeri 7’den büyük olur?
A) H₂SO₄ çözeltisi
B) NaOH çözeltisi
C) HNO₃ çözeltisi
D) CH₃COOH çözeltisi
Çözüm: NaOH bazik bir çözelti olduğundan pH değeri 7’den büyüktür. Cevap B.
4. Aşağıdakilerden hangisi bir tampon çözeltinin özelliğidir?
A) Sadece asit eklenirse pH sabit kalır.
B) Küçük miktarda asit veya baz eklendiğinde pH’ı sabit tutar.
C) Yalnızca baz eklendiğinde pH değişir.
D) Sadece saf su tampon görevi yapabilir.
Çözüm: Tampon çözeltiler, küçük miktarda asit veya baz eklendiğinde pH’ı sabit tutar. Cevap B.
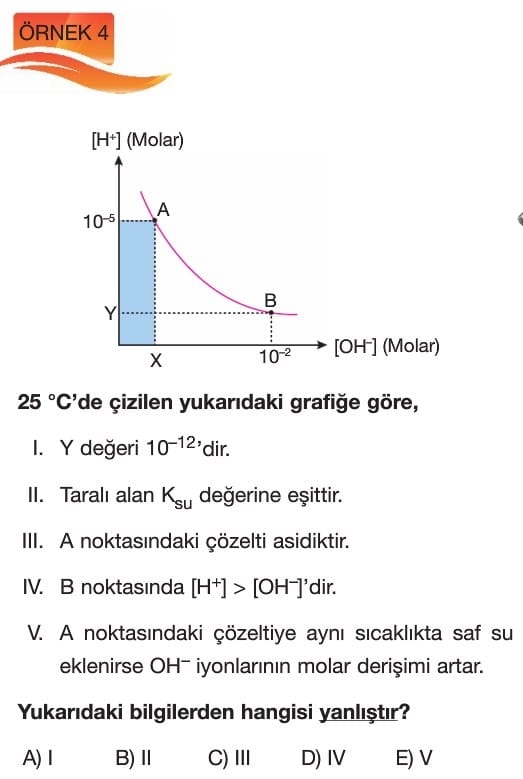
5. Aşağıdaki asit-baz tepkimelerinden hangisinin dengesi suyun iyonlaşma sabiti (Kw) ile ilgilidir?
A) HCl + NaOH
B) CH₃COOH + NH₃
C) H₂O ⇌ H⁺ + OH⁻
D) HNO₃ + KOH
Çözüm: Suyun iyonlaşması, Kw ile ilgilidir. Bu nedenle H₂O ⇌ H⁺ + OH⁻ tepkimesi suyun iyonlaşma sabitini içerir. Cevap C.
6. NaOH çözeltisine HCl eklenirse pH nasıl değişir?
A) Artar, çünkü baz eklenmiştir.
B) Azalır, çünkü asit eklenmiştir.
C) Sabit kalır, çünkü her iki madde nötralleşir.
D) Değişmez, çünkü güçlü asit ve baz birlikte tepkime vermez.
Çözüm: NaOH çözeltisine HCl eklendiğinde H⁺ iyonları OH⁻ iyonları ile nötralleşir ve pH azalır. Cevap B.