Sistemler ve Enerji Türleri Kimya Ayt
SİSTEMLER VE ENERJİ TÜRLERİ
Fiziksel ve kimyasal değişimlerde meydana gelen ısı değişimlerini inceleyen bilim dalına termokimya denir.
Enerjiyi ve enerji değişimleri sonucunda gerçekleşen olayları açıklayabilmek için termodinamik yasaları ortaya konulmuştur.
Sistem, evrenin incelenmek için seçilen belirli parçasıdır.
Ortam, evrenin sistem dışında kalan ve sistemle temas hâlinde olan kısmıdır. Evren ise sistem ve ortamı kapsar.
Sistemde meydana gelen sıcaklık, basınç ve hacim değişiklikleri ölçülebilir olmalıdır.
Sistem Çeşitleri
Açık Sistem: Ortam ile sistem arasında madde ve enerji alışverişi olan sistemlerdir. İnsan vücudu, ağaç yaprağı, ağzı açık bardaktaki çay açık sistem örnekleridir.
Kapalı Sistem: Ortam ile sistem arasında enerji alışverişi olan, madde alışverişi olmayan sistemlerdir. Pil ve ağzı kapalı şişedeki su kapalı sistem örnekleridir.
İzole Sistem: Ortam ile sistem arasında madde ve enerji alışverişi olmayan sistemlerdir. Termos bir izole sistem örneğidir.
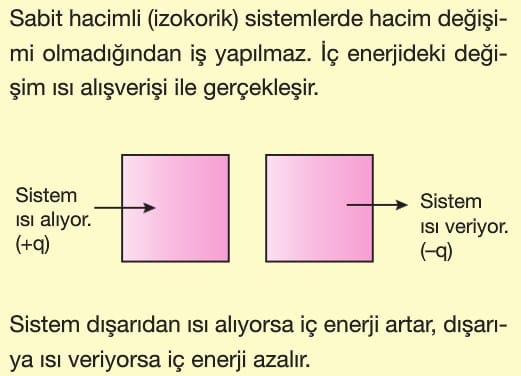
İzokorik Sistem: Ortam ile sistem arasında enerji alışverişi olan ve hacmi sabit tutulan sistemlerdir. Düdüklü tencere bir izokorik sistem örneğidir.
izotermal Sistem: Ortam ile sistem arasında madde ve enerji alışverişi olan ancak sıcaklığı sabit tutulan sistemlerdir. Klima, derin dondurucu ve yaklaşık 36,5 oC’deki insan vücudu izotermal sistem örnekleridir.
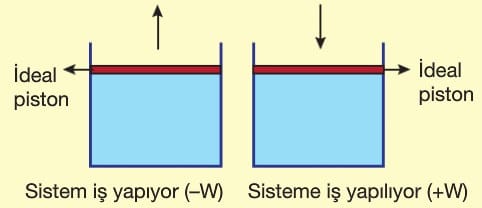
İzobarik Sistem: Ortam ile sistem arasında madde ve enerji alışverişi olan ancak basıncı sabit tutulan sistemlerdir. İdeal pistonlu kaplar ve balonlar izobarik sistem örnekleridir.
İç Enerji: Bir sistemin sahip olduğu toplam enerjisidir.
İç Enerji = Potansiyel enerji + Kinetik enerji
İç Enerji “U” harfi ile gösterilir. Bu sistemin iç enerjisi ölçülemez, ancak iç enerjideki değişim (ΔU) ölçülebilir.
Enerji, iş yapabilme kabiliyetidir.
Isı, sistem ile ortam arasında sıcaklık farkından dolayı aktarılan enerjidir. Enerji alışverişi sıcaklıklar eşitleninceye kadar devam eder. Sıcaklıkları eşit olan maddeler arasında ısı alışverişi gerçekleşmez.
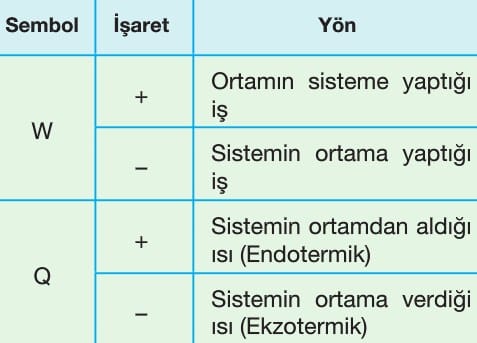
Isı, “Q” ya da “q” ile gösterilir. Isı alan bir sistemin iç enerjisi artarken, ısı veren bir sistemin iç enerjisi azalır.
İş, sistem ile ortam arasında sıcaklık farkı olmadan aktarılan enerjidir. “W” ile gösterilir.
Sabit basınçlı (İzobarik) sistemlerde hacmin değişmesiyle iş gerçekleşir.
Sistem iş yapıyorsa iç enerji azalır, sisteme iş yapılıyorsa iç enerji artar.
Termodinamiğin sıfırıncı yasasına göre; birbirine temas eden iki sistem arasında ısı alışverişi yoksa bu iki sistem birbiriyle ısıl dengededir. Yani sistemlerin sıcaklıkları eşittir.
Termodinamiğin Birinci Yasası
J Joule tarafından ifade edilen yasaya göre;
- Enerji farklı şekillerde olabilir. (Isı ve iş)
- Enerji dönüşebilir. (Mekanik enerjiden ısı enerjisine)
- Enerji yoktan var edilemez, var olan enerji de yok edilemez.
İç enerjinin, ısı ve işe bağlı olan değişimi termodinamiğin birinci yasasına uyar.
Termodinamik yasaları günlük hayatta;
- Isıtma ve soğutma sistemlerinde
- Buzdolaplarında
- Klimalarda
- Düdüklü tencerelerde
- Arabaların ateşleme sistemlerinde
- Barajlardaki elektrik üretiminde
- Turbojet motorlarında
- Kompresörlerde
kullanılır.
Buharlı trenlerin lokomotif kazanında yakılan odun ve kömürün iş yapabilme yeteneği vardır. Yanmayla birlikte iş yapabilme yeteneği suya aktarılarak suyun buharlaşması sağlanır. Oluşan buhar molekülleri bir piston yardımıyla iş yapabilme yeteneğini (enerjisini) tekerleklere aktararak tekerleklerin dönmesini ve lokomotifin hareket etmesini sağlar.
Yüksekten bırakıldıktan sonra yere çarparak zıplayan tenis topunun enerjisi sürekli olarak potansiyel enerjiden kinetik enerjiye, kinetik enerjiden potansiyel enerjiye dönüşür Tenis topu yüksekte iken potansiyel enerjisi büyüktür. Ancak bu enerjileri zamanla ısı enerjisine dönüşür ve top ile çevrenin ısı enerjisi artar.