Rutherford Atom Modeli 9. Sınıf Kimya
1911 yılında yaptığı çalışma ile alfa (He+2) taneciklerini ince altın bir levha üzerine göndermiş ve bu ışınların hareketlerini incelemiştir.
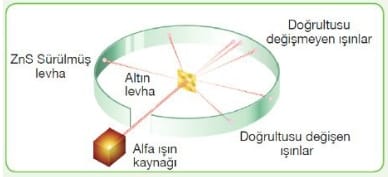
Alfa ışınlarının çoğu levhayı geçerken çok azı sapmaya uğramıştır.
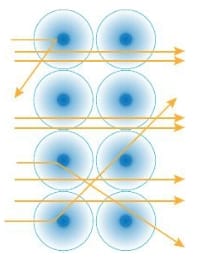
Böylece Rutherford’a göre ;
# Işınların çoğu levhadan geçtiğine göre atom boşluklu bir yapıya sahiptir.
# Işınların birçoğu sapma göstermediğine göre pozitif yüklü tanecikler çekirdek denilen çok küçük bir hacimde toplanmıştır.
# Çekirdeğin çapı yaklaşık 10-12 ile 10-13 cm civarıdır. Atomun çapı ise 10-8 cm’dir.
# Çekirdekteki (4) yük sayısı bir elementin tüm atomlarında aynıdır.
# Atomda elektronların kapladığı hacim, çekirdeğin hacminden çok daha büyüktür.
# Atomda pozitif yük sayısı kadar negatif yük vardır. (nötr atom)
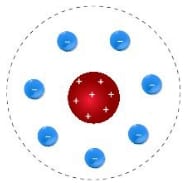
# Yani atomda elektron sayısı proton sayısına eşittir.
# Çekirdek ile elektronlar arasındaki çekim kuvvetinden dolayı elektronların (-) çekirdek etrafında dönmeleri gerektiğini savunmuştur.
# Atomun kütlesi, (4) yüklü taneciklerin kütlesinin yaklaşık iki katı kadardır demiştir. O halde çekirdekte kütlesi protonun kütlesi kadar olan yüksüz tanecikler vardır.
Rutherford Atom Modelinin Eksikleri İse ;
# Elektronların niçin çekirdek üzerine düşmediği gibi birçok elektron hareketini açıklamaya yetmemiştir.
# Nötronların varlığını tahmin etmiştir fakat ispatlayamamıştır.
# Nötronların varlığını CHADWİCK 1932 de kanıtladı.
Not: Rutherford’un atom modeli gezegen modeli olarak bilinmektedir. Çekirdek Güneş, çekirdeğin etrafındaki elektronlarda gezegenlere benzetilmiştir.