Periyodik Tabloda Yer Bulma 9. Sınıf Kimya Ders Notu
Periyodik tablo, kimyasal elementlerin atom numaralarına ve özelliklerine göre düzenlendiği bir çizelgedir ve kimyanın en temel araçlarından biridir. Bu tablo, elementlerin atom yapıları, proton, nötron ve elektron sayıları ile periyodik özelliklerini anlamamıza yardımcı olur. Soldan sağa gidildikçe atom numarası artarken, benzer kimyasal özelliklere sahip elementler aynı grupta yer alır. Gruplar, elementlerin dikey sıraları olup, periyotlar ise yatay sıraları ifade eder. Elementlerin periyodik tablodaki yerini belirlemek, onların fiziksel ve kimyasal özelliklerini anlamamıza olanak sağlar ve bu bilgi kimyada birçok hesaplamada kullanılmaktadır.
Atomdan Periyodik Tabloya Testleri
9. Sınıf Periyodik Tabloda Yer Bulma Ders Notu
Periyodik tablonun gelişiminde birçok bilim insanının katkısı vardır. Dimitri Mendeleyev’in geliştirdiği periyodik tablo, günümüzde kullanılan tabloya en çok benzeyen ilk tablodur. Mendeleyev elementleri kütle numaralarına göre sıralamıştır. Günümüzde ise periyodik tablo, Henry Moseley’in elementlerin artan atom numaralarına göre sıralanması ile oluşmuştur.
- Periyodik tabloda yatay sıralara periyot, dikey sütunlara ise grup adı verilir. Periyodik sistemde 7 tane periyot ve 18 tane grup bulunur. 18 gruptan 8 tanesi A grubu, 10 tanesi B grubudur.
- Aynı grupta yer alan elementlerin kimyasal özellikleri genellikle birbirine benzer.
- Bir elementin periyodik tablodaki periyot numarası, temel haldeki en büyük enerji düzeyi sayısıdır. Grup numarası ise elementin değerlik (valans) elektron sayısını gösterir. (Örneğin, Helyum’un (He) değerlik elektron sayısı 2’dir. Bu nedenle periyodik tabloda 8A grubunda yer alır.)
- IUPAC’a göre periyodik sistemde gruplar 1’den 18’e kadar numaralandırılır. 1. grup, 2. grup… şeklinde devam eder ve 18. grupta sona erer.
A Grubu Elementleri için Grup Numaraları
| Periyodik sistemde grup numarası | Elektron diziliminde son orbitaller |
|---|---|
| 1A | ns¹ |
| 2A | ns² |
| 3A | ns²np¹ |
| 4A | ns²np² |
| 5A | ns²np³ |
| 6A | ns²np⁴ |
| 7A | ns²np⁵ |
| 8A | ns²np⁶ |
B Grubu Elementleri İçin Grup Numaraları
| Periyodik sistemde grup numarası | Elektron diziliminde son orbitaller |
|---|---|
| 3B | ns² (n−1)d¹ |
| 4B | ns² (n−1)d² |
| 5B | ns² (n−1)d³ |
| 6B | ns¹ (n−1)d⁵ |
| 7B | ns² (n−1)d⁵ |
| 8B | ns² (n−1)d⁶ |
| 8B | ns² (n−1)d⁷ |
| 8B | ns² (n−1)d⁸ |
| 1B | ns¹ (n−1)d¹⁰ |
| 2B | ns² (n−1)d¹⁰ |
Bazı elementlerin elektron dizilimlerinden faydalanılarak, periyodik tablodaki periyot ve grup numaralarının bulunmasına dair örnekler aşağıda verilmiştir.
Periyodik Sistem Örnekleri:
- Sodyum (Na)
Elektron dizilimi: 1s² 2s² 2p⁶ 3s¹
3. periyot, 1A grubu (IUPAC’a göre 1. grup) - Klor (Cl)
Elektron dizilimi: 1s² 2s² 2p⁶ 3s² 3p⁵
3. periyot, 7A grubu (IUPAC’a göre 17. grup) - Vanadyum (V)
Elektron dizilimi: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d³
4. periyot, 5B grubu (IUPAC’a göre 5. grup) - Germanyum (Ge)
Elektron dizilimi: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p²
4. periyot, 4A grubu (IUPAC’a göre 14. grup) - Helyum (He)
Elektron dizilimi: 1s²
1. periyot, 8A grubu (IUPAC’a göre 18. grup)
Katman Elektron Diziliminden Yararlanarak Periyodik Sistemde Yer Bulma
- Elementlerin periyodik cetveldeki yerlerini bulabilmek için nötr haldeki elektron sayıları bilinmelidir.
- Elektronlar katmanlara yerleştirilirken çekirdeğe en yakın katmandan başlar. K katmanı en fazla 2 elektron, L katmanı en fazla 8 elektron, M katmanı en fazla 18 elektron, N katmanı ise en fazla 32 elektron alabilir.
- Elektronların yerleştiği katman sayısı, elementin periyodik tablodaki periyot numarasını verir.
- Katman elektron diziliminde son katmandaki elektron sayısı, elementin periyodik tablodaki grup numarasını gösterir.
Örnek: Bu kurallar, elementlerin periyodik cetveldeki yerlerinin kolayca bulunmasına yardımcı olur.

Valans Orbitalleri ve Valans Elektronları
- Bir atomun en yüksek enerji seviyesine sahip orbitallerine valans (değerlik) orbitalleri denir. Bu orbitallerde bulunan elektronlara ise valans elektronları denir.
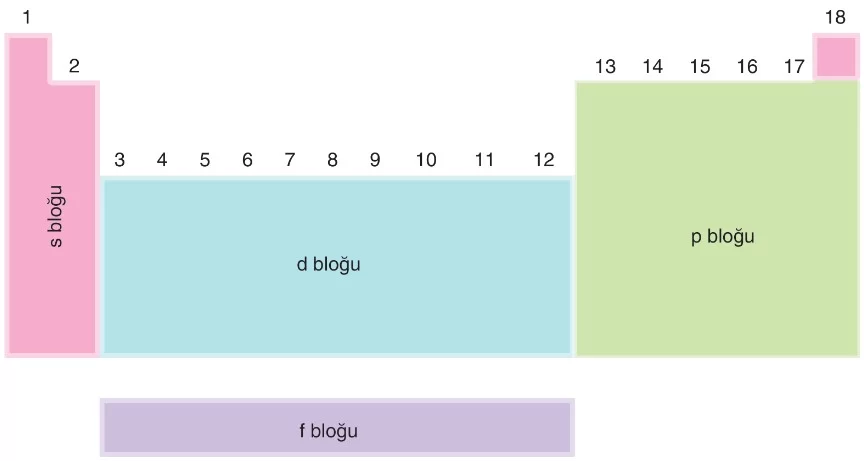
- s ve p bloğu elementlerine baş grup elementleri denir.
- d bloğu elementlerine yan grup elementleri denir.
| Elektron diziliminde son orbitaller | Valans orbitalleri | Valans elektron sayısı |
|---|---|---|
| nsa | s | n |
| nsanpb | s, p | n + x |
| nsa(n−1)db | s, d | n + x |
| nsa(n−1)d¹⁰npb | s, p | n + x |
Aşağıda bazı atomların valans elektron sayıları ve valans orbital türleri verilmiştir.

- s bloğu: Temel hâldeki elektron dizilimi s ile sonlanan elementler bulunur. Bu bloğa ait elementlere “s bloğu elementleri” denir. Örneğin, Helyum (He) bir s bloğu elementidir.
- p bloğu: Temel hâldeki elektron dizilimi p ile sonlanan elementler bulunur. Bu bloğa ait elementlere “p bloğu elementleri” denir.
- d bloğu: Temel hâldeki elektron dizilimi d ile sonlanan elementler bulunur. Bu bloğa ait elementlere “d bloğu elementleri” veya “geçiş metalleri” denir.
- f bloğu: Temel hâldeki elektron dizilimi f ile sonlanan elementler bulunur. 4f ile sonlanırsa “lantanitler”, 5f ile sonlanırsa “aktinitler” olarak adlandırılır. Bu bloğa ait elementlere “f bloğu elementleri” veya “iç geçiş elementleri” de denir.
Çözümlü Test Soruları
Soru 1:
Aşağıdaki elementlerden hangisi periyodik tabloda 8. grup elementidir?
A) Oksijen (O)
B) Neon (Ne)
C) Klor (Cl)
D) Kalsiyum (Ca)
E) Demir (Fe)
Cevap: B (Neon)
Çözüm: Neon, periyodik tabloda 8. grup (soygazlar) elementidir.
Soru 2:
Karbon (C) elementi periyodik tabloda hangi grup ve periyotta yer alır?
A) 4. grup, 2. periyot
B) 14. grup, 2. periyot
C) 4. grup, 4. periyot
D) 6. grup, 3. periyot
E) 5. grup, 2. periyot
Cevap: B (14. grup, 2. periyot)
Çözüm: Karbon, periyodik tabloda 14. grup ve 2. periyotta yer alır.
Soru 3:
Aşağıdaki elementlerden hangisi metal olarak sınıflandırılır?
A) Amonyum (NH4)
B) Kükürt (S)
C) Magnezyum (Mg)
D) Oksijen (O)
E) Klor (Cl)
Cevap: C (Magnezyum)
Çözüm: Magnezyum, metal özellikleri gösteren bir elementtir.
Soru 4:
Aşağıdaki elementlerin hangisi alkali metaller grubundadır?
A) Sodyum (Na)
B) Kalsiyum (Ca)
C) Demir (Fe)
D) Gümüş (Ag)
E) Bakır (Cu)
Cevap: A (Sodyum)
Çözüm: Sodyum, 1. grup (alkali metaller) elementidir.
Soru 5:
Periyodik tabloda yer alan Halojenler hangi grupta yer alır?
A) 1. grup
B) 2. grup
C) 13. grup
D) 17. grup
E) 18. grup
Cevap: D (17. grup)
Çözüm: Halojenler, periyodik tabloda 17. grupta yer alır.
Soru 6:
Argon (Ar) elementinin periyodik tabloda hangi grup ve periyotta bulunduğunu belirleyin.
A) 2. grup, 3. periyot
B) 18. grup, 3. periyot
C) 8. grup, 4. periyot
D) 16. grup, 3. periyot
E) 17. grup, 4. periyot
Cevap: B (18. grup, 3. periyot)
Çözüm: Argon, periyodik tabloda 18. grup (soygazlar) ve 3. periyotta yer alır.
Soru 7:
Aşağıdaki elementlerden hangisi ağır metal olarak kabul edilir?
A) Alüminyum (Al)
B) Kobalt (Co)
C) Lityum (Li)
D) Berilyum (Be)
E) Sodyum (Na)
Cevap: B (Kobalt)
Çözüm: Kobalt, periyodik tabloda ağır metaller arasında yer alır.
Soru 8:
Periyodik tabloya göre, 3. periyotta bulunan ve sodyumdan sonraki ilk element hangisidir?
A) Magnezyum (Mg)
B) Alüminyum (Al)
C) Silikon (Si)
D) Fosfor (P)
E) Klor (Cl)
Cevap: C (Silikon)
Çözüm: Sodyumdan sonra 3. periyotta yer alan element silikon (Si)dir.
Soru 9:
Hangi element, periyodik tabloda 2. grup elementleri arasında yer alır?
A) Karbon (C)
B) Sodyum (Na)
C) Kalsiyum (Ca)
D) Potasyum (K)
E) Magnezyum (Mg)
Cevap: E (Magnezyum)
Çözüm: Magnezyum, periyodik tabloda 2. grup (toprak alkali metaller) elementidir.
Soru 10:
Aşağıdaki elementlerden hangisi soy gaz olarak adlandırılır?
A) Klor (Cl)
B) Asetil (C2H2)
C) Neon (Ne)
D) Oksijen (O)
E) Kükürt (S)
Cevap: C (Neon)
Çözüm: Neon, periyodik tabloda 18. grup (soy gazlar) elementidir.





Aşırı beğendim gayette açıklayıcı olmuş sorular da pekiştirme amaciyla eklenmiş fakat cevapları en altta yazsaydı keşke biz cevaplayıp doğru veya yanlışlarimiza bakabilirdik ama şimdi soruyu az alta indiriyorum cevap gözüküyor onun haricinde başarılı olmuş 🌸💯