Periyodik Sistem: Tarihçesi ve Özellikleri Kimya Ayt
PERİYODİK SİSTEM
Periyodik cetveli modern hale getiren kişi Henry Moseley ’dir. Yaptığı çalışmalarda periyodik cetveli atom numarası artışına göre düzenlemiştir.
Periyodik cetvelde atomların elektron dizilimleri Aufbau, Pauli ve Hund kurallarından yola çıkılarak yazılmıştır. Aufbau elektronların düşük enerjili orbitallerden yüksek enerjili orbitallere doğru yerleşeceğini, Pauli bir orbitalin en fazla 2 elektron alacağını ve bunların birbirine zıt yönlü olacağını, Hund aynı enerji seviyesindeki orbitallere elektronların önce birer birer ve aynı yönlü yerleşeceğini belirtmiştir.
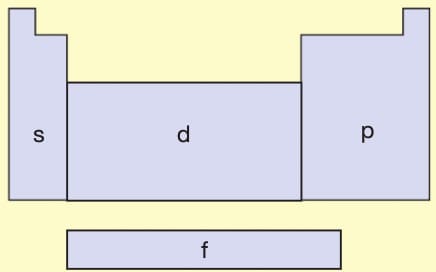
— Periyodik cetvel 4 bloktan oluşur. Bunlar s bloğu, p bloğu, d bloğu ve f bloğudur.
Bir atomun hangi blokta olduğunu son elektronun bulunduğu orbital türü belirler. Bir atomun en son enerji düzeyine değerlik kabuğu (valens) ve burada bulunan elektronlara ise değerlik elektronu denir.
Periyodik cetveldeki atomların elektron dizilişi yazılırken soygazların atom numaraları kullanılabilir.
Periyodik Cetvelde Yer Bulma
Periyodik cetvelde yeri bulunacak elementin nötr ve temel hal elektron dizilimi yapılır. Bu dizilimde;
— En büyük baş kuantum sayısı periyodu verir.
Periyodik Özellikler
Atom Yarıçapı:
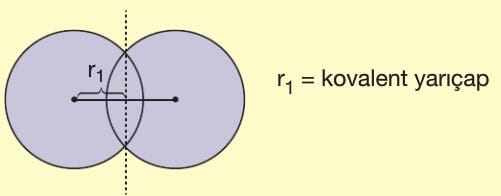
A) Kovalent Yarıçap: Tek bağ yapan iki ametal atomunun çekirdekleri arasındaki uzaklığın yarısına denir.
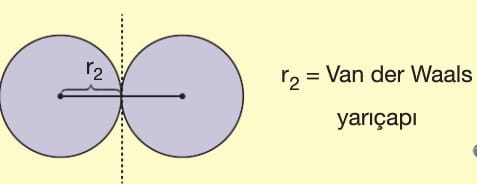
B) Van der Waals Yarıçapı: Soygaz atomlarının katı haldeki durumunda çekirdekler arasındaki uzaklığın yarısına denir.
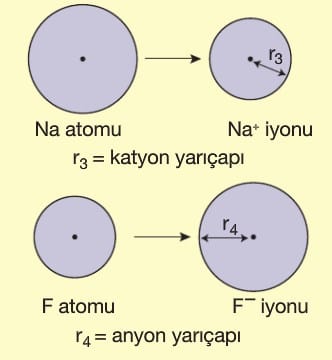
C) İyon yarıçapı: İyonik yapılı bileşiklerde anyon ve katyonların yarıçaplarına denir. Metal elektron verirken hacmi küçülür ve katyon yarıçapını oluşturur. Anyon elektron alırken hacmi büyür ve anyon yarıçapını oluşturur.
Periyodik cetvelde atom yarıçapı soldan sağa doğru gidildikçe genellikle azalır. Bunun nedeni proton sayısının artması ile çekim kuvvetinin artmasıdır.
Grupta yukarıdan aşağıya doğru gidildikçe kabuk sayısı artar ve hacim artar.
Metalik ve Ametalik Özellik
Periyodik cetvelde sağdan sola ve yukarıdan aşağıya doğru gidildikçe atom çapı genellikle artar bu da elektron vermeyi kolaylaştırır. Metalik özelliği artırır.
Periyodik cetvelde soldan sağa ve aşağıdan yukarıya doğru gidildikçe atom çapı genellikle azalır. Elektron almak kolaylaşır. Bu da ametalik özelliği artırır.
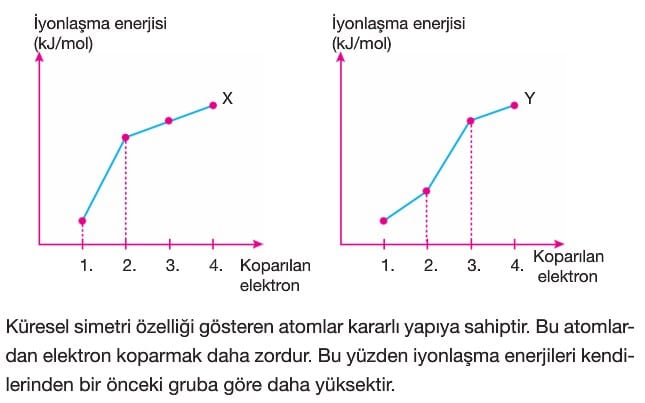
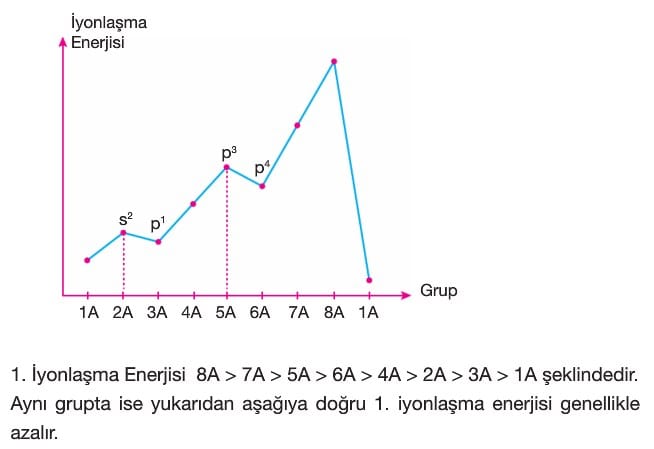
İyonlaşma Enerjisi
Gaz halindeki bir atomun 1 molünün 1 mol elektron vermesi durumunda harcanan enerjiye 1. iyonlaşma enerjisi denir. Her elektron için bir iyonlaşma enerjisi vardır. Elektron koparıldıkça iyonlaşma enerjisi artar. Nötr bir atomda elektron sayısı kadar iyonlaşma enerjisi olduğundan iyonlaşma enerjisi sayısı atom numarasını verir.
Bir atom elektron verip soygaz elektron düzenine ulaştığında elektron koparmak zordur. Bu da iyonlaşma enerjileri arasında büyük bir sapmaya neden olur. A gruplarında bu sapmanın olduğu iyonlaşma enerjisi sayısı atomun grup numarasını bulmamızı sağlar. İyonlaşma enerjisinin 3,5 kat ya da daha fazla arttığı yere bakılır.
Asitlik ve Bazlık Kuvveti
Metallerin oksitleri ve hidroksitleri bazik karakterlidir. Bu bileşiklerin sulu çözeltisi baz özelliği gösterir.
Metal bileşiklerinin bazik karakteri sola ve aşağı doğru artar.
Ametallerin oksitleri ve hidrojenli bileşikleri asidik karakterlidir. Bu bileşiklerin sulu çözeltileri asittir. Asitlik periyodik sistemde sağa doğru artar. Ametal oksitlerde asitlik yukarı doğru artarken halojenlerin hidrojenli bileşiklerinde asitlik aşağı doğru artar.