Periyodik Sistem 8.Sınıf Fen
Atomun Yapısı
Bütün maddeler tanecikli yapıdan oluşmuşlardır. Yani her maddenin özelliklerini gösteren en küçük birimi 0 maddenin taneciği olarak ifade edilir. Karışımlar farklı cins taneciklerin fiziksel yollarla bir araya gelmesi sonucu oluşan maddeler, bileşikler ise en az iki elementin kimyasal yollarla bir araya gelmesi sonucunda oluşan maddelerdir. Elementler ise tek cins atomdan oluşan maddeler olarak tanımlanırlar. Sonuçta karışımların, bileşiklerin ya da elementlerin yapılarında mutlaka atom dediğimiz tanecikler vardır.
Atom bir elementin fiziksel ve kimyasal yollarla parçalanamayan en küçük taneciğidir. Yani bütün maddeler atom denilen taneciklerden oluşurlar. Karışım ve bileşiklerde farklı atomlar, elementlerde ise tek cins atom bulunur. Atom çok küçük bir taneciktir. Günümüzde teknolojik olarak bir milyon kez büyüten elektron mikroskobunda bile atomun iç yapısının incelenmesi mümkün değildir.
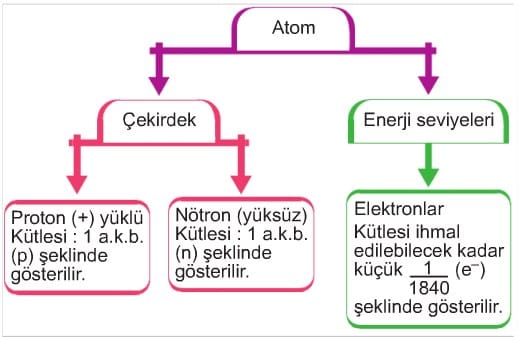
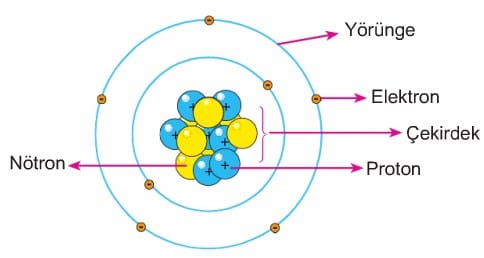
Uzun yıllardan bu yana atomun yapısı ile ilgili olarak bilim insanları birçok fikirler ortaya atmışlar ve zamanla bu fikirler geliştirilmiştir. Günümüzde atomun yapısı ile ilgili olarak kabul edilen görüşler Modern Atom Teorisi olarak bilinir. Modern atom teorisine göre, atom temel olarak çekirdek ve enerji seviyeleri olmak üzere iki ana bölgeden oluşur. Atom çekirdeğinde pozitif yüklü protonlar ve yüksüz nötronlar bulunur. Atomun enerji seviyelerinde (yörüngeler) ise negatif yüklü elektronlar bulunur. Çekirdekte bulunan proton ve nötronların kütleleri birbirine eşittir ve her birinin kütlesi 1 atomik kütle birimi (a.k.b) olarak ifade edilir. Yörüngelerdeki elektronların kütleleri ise ihmal edilecek kadar küçüktür. Bu durumu bir şema halinde gösterelim.
İyon Kavramı
Elektron alışverişi yapmamış atomlar yüksüz yani nötrdür. Elektron alışverişi yapmış atomlara iyon denir. İyon yükü, element sembolünün sağ üst köşesine yazılır. İyon yükü pozitif veya negatiftir. Atom verdiği elektron sayısı kadar pozitif (+), aldığı elektron sayısı kadar negatif (-) iyon yükü alır.
Atomların Elektrik Yüklü Hâlleri
Atomun elektron vermesi sonucu oluşan pozitif yüklü iyona katyon, elektron alması sonucu oluşan negatif yüklü iyona anyon denir.
Elektron Dağılımı
Proton ve nötronlar atomda çok küçük bir hacim işgal eden çekirdekte sıkışmışlardır. Bu taneciklerin çekirdekte belirli bir düzeni yoktur. Ancak elektronlar çekirdekten belirli uzaklıklarda enerji seviyelerine yerleşmiş ve çekirdek çevresinde sürekli dönmektedirler. Elektronlar arasında çok büyük boşluklar vardır. Atomdaki elektronların dağıldığı enerji seviyelerinde bulunabilecek elektron sayıları belirlidir. Elektronların enerji seviyelerine dağılımı ile ilgili iki temel kural vardır.
Elektronlar temel enerji seviyelerine 2.n2 formülüne göre yerleşirler. (n = Yörünge numarası)
Elementlerin Periyodik Tablodaki Yerlerinin Bulunması (Grup – Periyot Bulma)
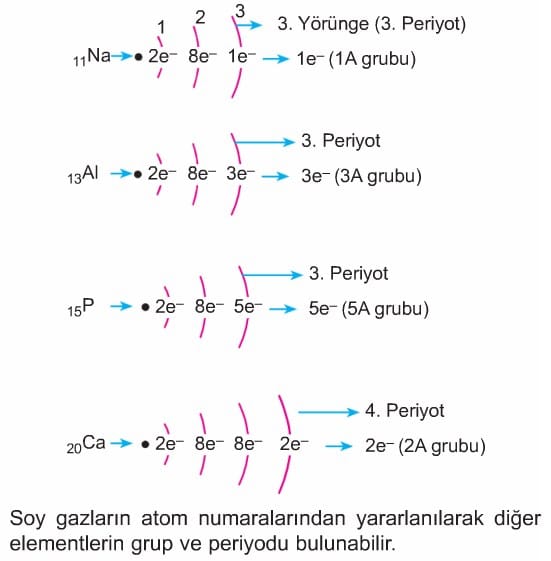
Elementlerin periyodik tablodaki yerlerine bakılırken atom numaraları dikkate alınır. Elementlerin nötr hallerinde e– dağılımı yapılır;
Yörünge sayısı –> Periyot numarası
Son yörüngedeki e– sayısı –› Grup numarasını verir.
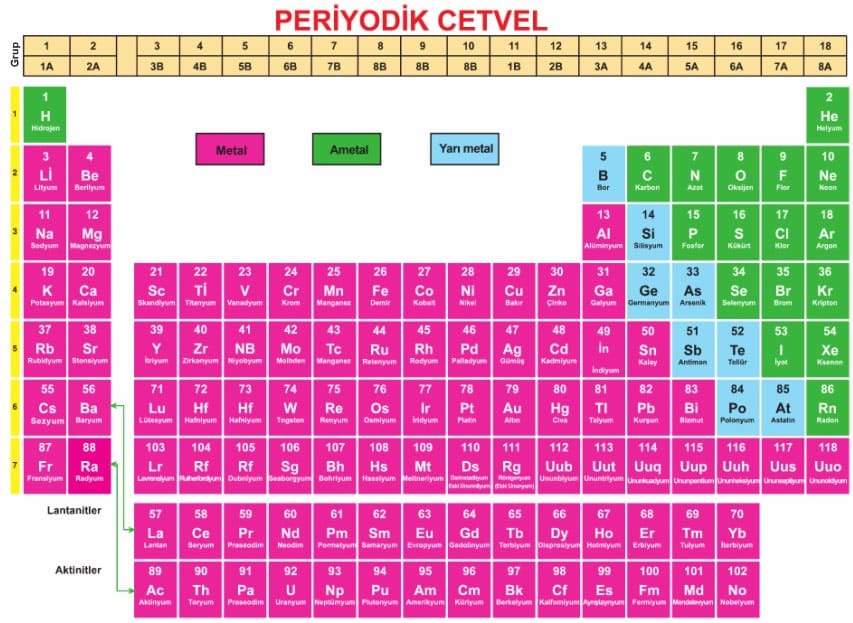
Periyodik Tablo
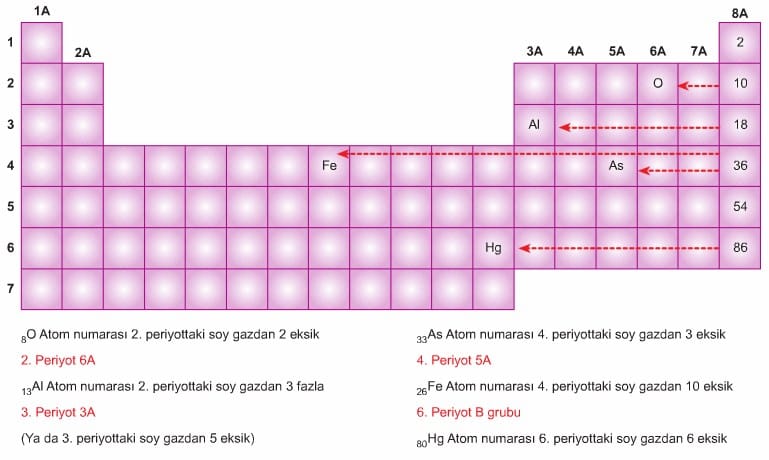
Periyodik tablo, elementleri gösteren ve özellikleriyle ilgili bilgi veren bir tablodur. Bu tabloda elementler artan atom numaralarına göre sıralanmıştır. Yatay sıralara periyot, düşey sütunlara ise grup adı verilir. Aynı gruptaki elementler birbirleriyle benzer özellikler gösterirler. Periyodik cetvelin en sağındaki düşey grupta yer alan elementlere soy gaz (asal gaz) adı verilir. Bu elementler çok kararlıdır. Periyodik tablodaki elementler üç ana grupta toplanabilir. Bunlar metaller, ametaller ve soy gazlardır.
- Periyodik cetvelde 7 tane periyot vardır.
- Her periyot bir soy gaz ile sonlanır.
- 1. periyot hariç her periyot bir alkali metal ile başlar.
- 1. periyodun ilk elementi olan hidrojen bir ametaldir.