Periyodik Sistem 8.Sınıf Fen Bilimleri
Bu bölümde; geçmişten günümüze periyodik sistemin oluşturulma sürecini, periyodik sistemdeki grup ve periyotların nasıl oluşturulduğunu, elementlerin metal, ametal, yarı metal ve soygaz olarak sınıflandırıldığını açıklayacağız.
– Doğada bulunan 100’den fazla elementi daha kolay incelemek için elementler çeşitli özelliklerine göre sınıflandırılmıştır.
– Elementlerin sınıflandırılması ile ilgili çalışmalar çok eskilere dayanır. Bunlardan bazıları şöyledir:
 Bu konuyla ilgili ilk çalışmayı 1829 yılında Johann Döbereiner, benzer özellik gösteren elementlerden üçlü gruplar oluşturarak gerçekleştirmiştir. Ona göre; lityum, sodyum, potasyum benzer özellikler gösterdiği için bir grup oluşturuyordu.
Bu konuyla ilgili ilk çalışmayı 1829 yılında Johann Döbereiner, benzer özellik gösteren elementlerden üçlü gruplar oluşturarak gerçekleştirmiştir. Ona göre; lityum, sodyum, potasyum benzer özellikler gösterdiği için bir grup oluşturuyordu.
 Benzer fiziksel özellik gösteren elementleri dikey sıralarda olacak şekilde sarmal olarak gruplandırmıştır. Fakat bu listede elementlerin dışında bazı iyonlara ve bileşiklere de yer vermiştir.
Benzer fiziksel özellik gösteren elementleri dikey sıralarda olacak şekilde sarmal olarak gruplandırmıştır. Fakat bu listede elementlerin dışında bazı iyonlara ve bileşiklere de yer vermiştir.
 O devirde bilinen 62 elementi artam atom ağırlıklarına göre sıralamış, ilk 8 elementten sonra benzer fiziksel ve kimyasal özelliklerin tekrar ettiğini fark etmiştir.
O devirde bilinen 62 elementi artam atom ağırlıklarına göre sıralamış, ilk 8 elementten sonra benzer fiziksel ve kimyasal özelliklerin tekrar ettiğini fark etmiştir.

 Mendeleyev ve Meyer birbirlerinden habersiz, aynı dönemde elementleri sınıflandırmış ve aynı sıralamayı bulmuşlardır. Ancak
Mendeleyev ve Meyer birbirlerinden habersiz, aynı dönemde elementleri sınıflandırmış ve aynı sıralamayı bulmuşlardır. Ancak
Meyer elementleri benzer fiziksel özelliklerine göre sıralarken, Mendeleyev bu sıralamada atom ağırlığını göz önünde bulundurmuştur.
 Günümüzde kullanılan modern periyodik sistemin temeli, protonun keşfine dayanmaktadır. Henry Moseley (Henri Mozeli) adlı bilim insanı, elementleri proton sayılarına (atom numaralarına) göre düzenlenmiştir.
Günümüzde kullanılan modern periyodik sistemin temeli, protonun keşfine dayanmaktadır. Henry Moseley (Henri Mozeli) adlı bilim insanı, elementleri proton sayılarına (atom numaralarına) göre düzenlenmiştir.
Henry Moseley’in elementleri proton sayılarının artışına göre sıralamasından sonra, son değişiklik Glenn Seaborg (Gılen Siborg) tarafından gerçekleştirilmiştir. Glenn Seaborg, periyodik sistemin altına iki sıra daha ekleyerek periyodik sisteme son şeklini vermiştir.
Bugün kullandığımız periyodik cetvel, elementlerin atom numaralarına göre sıralanması ve benzer kimyasal özellikteki elementlerin alt alta getirilmesi ile oluşturulmuştur.
Periyodik cetvelde elementlerin artan atom numaralarına göre yan yana sıralanması ile oluşan yatay sıralara periyot denir.
Periyodik cetvelde 7 tane periyot vardır.
Periyodik cetvelde benzer kimyasal özellik gösteren elementlerin alt alta sıralanması ile oluşan düşey sütunlara grup denir.
Periyodik cetvelde 8 tane A ve 10 tane B olmak üzere 18 grup vardır.
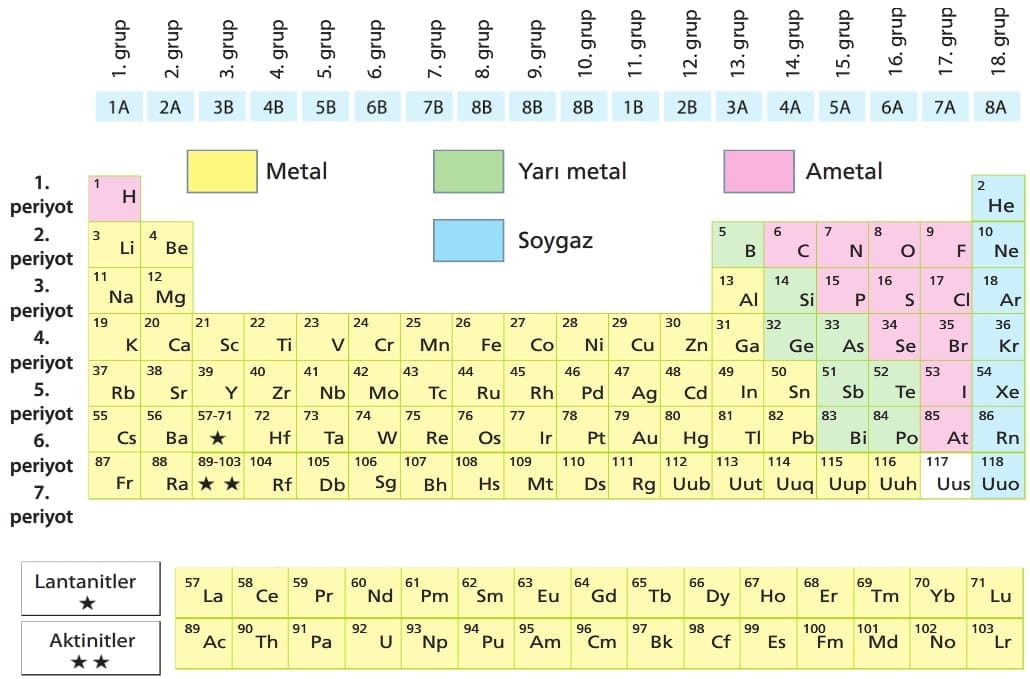
– Periyodik cetvelin l. periyodunda H ve He olmak üzere iki element vardır.
– Periyodik cetvelin 2. periyodu Li ile başlar, Ne ile biter ve 8 element bulundurur.
– Periyodik cetvelin 3. periyodu Na ile başlar, Ar ile biter ve 8 element bulundurur.
– Periyodik tablodaki bazı grupların özel isimleri vardır.
1A —> Alkali metaller, 7A —> Halojenler
2A —>Toprak alkali metaller, 8A —> Soygazlar
Bir elementin periyodik cetveldeki yeri, nötr durumdaki elektron dağılımına bakılarak bulunabilir. Elektron dağılımı yapıldıktan sonra,
— Elektron bulunduran katman sayısı periyot numarasını
— Son katmandaki elektron sayısı grup numarasını belirtir.

