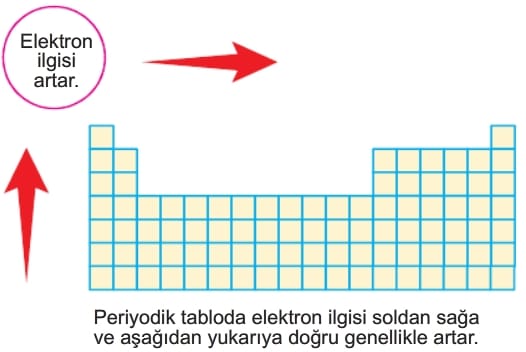
Periyodik Özelliklerin Değişimi: Elektron İlgisi 9.Sınıf Kimya
Elektron İlgisi
Gaz hâlindeki nötr bir atomun elektron yakalayarak 1— yüklü iyon oluşturması sırasında meydana gelen ısı değişimine elektron ilgisi denir. Atom elektron yakaladığında açığa çıkan enerji elektron ilgisinin ölçüsüdür.
Azot ve florun elektron ilgisi denklemlerini inceleyelim.
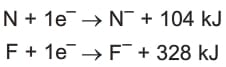
Buradan azotun elektron ilgisinin —104 kJ.mol-1 ve florun elektron ilgisinin —328 kJ.mol-1 olduğu anlaşılır. Florda daha çok enerji açığa çıktığı için florun elektron ilgisi, azotun elektron ilgisinden büyüktür. Atom çapı küçüldükçe açığa çıkan ısı genellikle artar. Yani aynı periyotta sağa doğru gidildikçe ve aynı grupta yukarı doğru çıkıldıkça elektron ilgisi genellikle artar. Negatif işaretli değerlerde yorum yapılırken enerjinin önündeki eksi işareti ısının dışarı çıktığını göstermektedir. Yani sayının mutlak değeri alınarak yorum yapılmalıdır.