Periyodik Özellikler Kimya Tyt
PERİYODİK ÖZELLİKLER
Bilim insanları son olarak elementleri artan atom numaralarına göre sıralamışlardır. Bu sıralamaya bağlı olarak elementlere ait bir takım özelliklerin atom yarıçapı, iyonlaşma enerjisi, elektron ilgisi, elektronegatiflik gibi değişimleri incelemişlerdir.
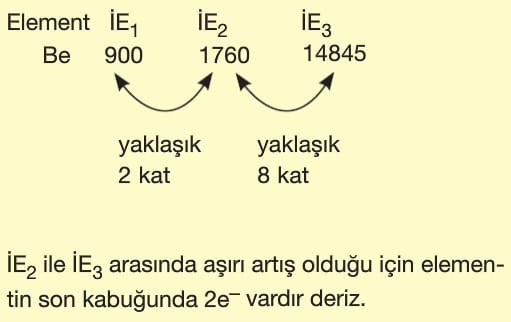
NOT: İyonlaşma enerjisi değerleri ile grup numarası bulmak için iyonlaşma enerjisinin 3,5 kat ya da daha fazla artış gösterdiği yere bakılır.
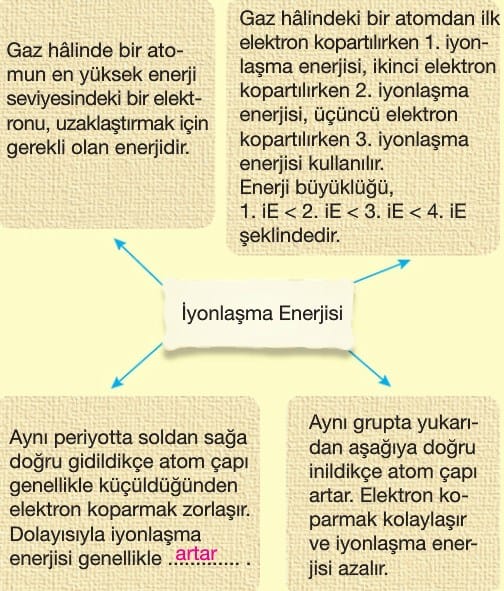
Aynı periyotta soldan sağa doğru gidildikçe iyonlaşma enerjisi genellikle artar. Ancak bazı gruplarda atomların küresel simetri özelliğinden dolayı değişiklik gözlenir.
Bunun sonucu olarak aynı periyotta iyonlaşma enerjisi değişimi; 1A<3A<2A<4A<6A<5A<7A<8A _ şeklindedir.
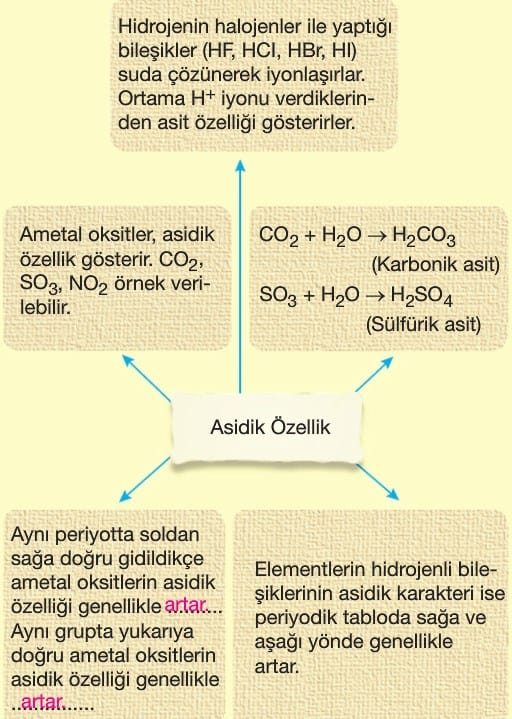
Bir asitin yapısında merkez atomu— nun yükseltgenme basamağı arttıkça. merkez atom, bağ elektronlarını çok çekerek hidrojen iyonlarını (H+) suya daha kolaylıkla verir. Dolayısıyla asitlik kuvveti artar.
Asit kuvveti; HCIO4 > HCIO3 > HCIO2 > HCIO şeklinde olur.
Özet olarak periyodik tabloda soldan sağa doğru gidildikçe elementlerin;
- Atom numarası artar.
- Değerlik elektron sayısı artar.
- Atom hacmi (çapı) azalır.
- İyonlaşma enerjisi artar.
- Oksitlerin asidik özelliği artar.
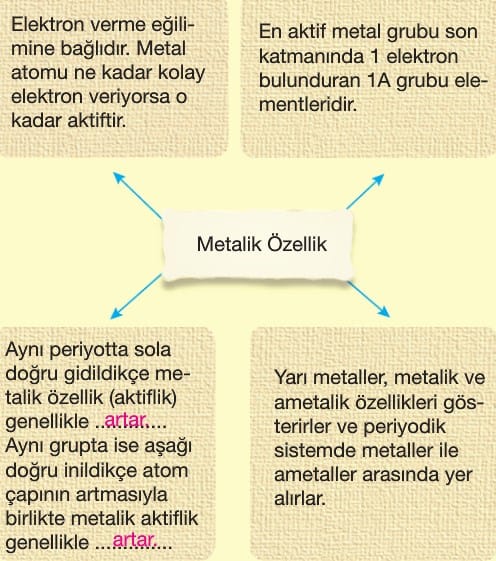
- Metalik özellik azalır.
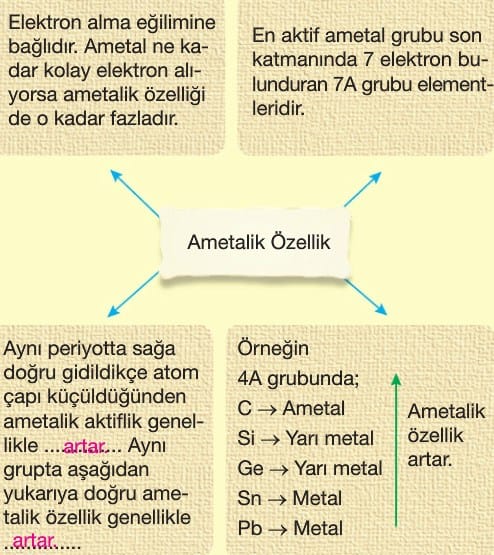
- Ametalik özellik artar.
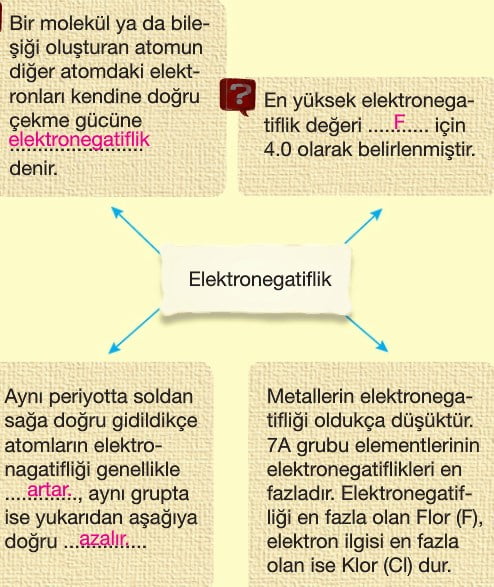
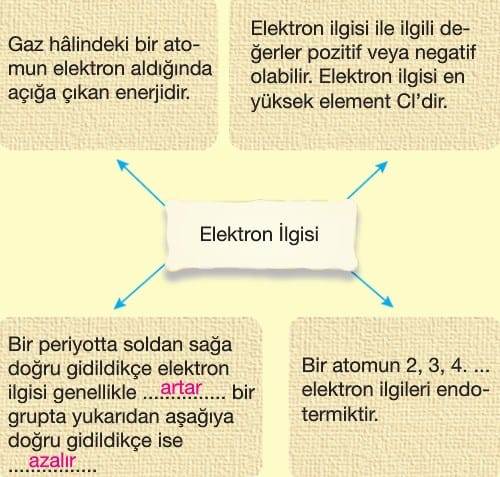
- Elektron ilgisi ve elektronegatiflik artar.
- Hidrojenli bileşiklerin asidik özelliği artar.
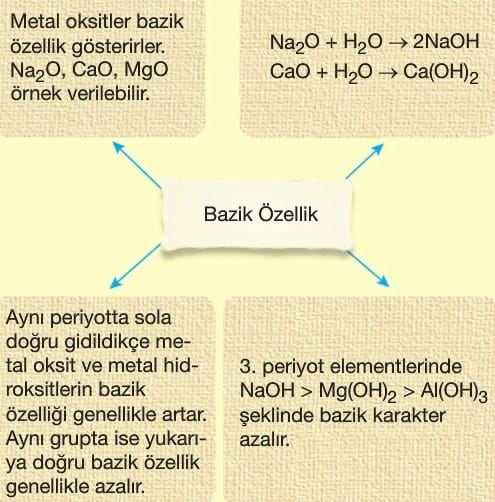
- Oksit ve hidroksit bileşiklerinin bazik özelliği azalır.
Periyodik tabloda bir grupta aşağıya doğru gidildikçe elementlerin;
- Atom numarası artar.
- Değerlik elektron sayısı değişmez.
- Atom hacmi (çapı) artar.
- İyonlaşma enerjisi azalır.
- Oksitlerin asit özelliği azalır.
- Metalik özellik artar.
- Ametalik özellik azalır.
- Elektron ilgisi ve elektronegatiflik azalır.
- Hidrojenli bileşiklerin asidik özelliği artar.
- Oksit ve hidroksit bileşiklerinin bazik özelliği artar.