Periyodik Özellikler 9. Sınıf Kimya
Periyodik Özellikler
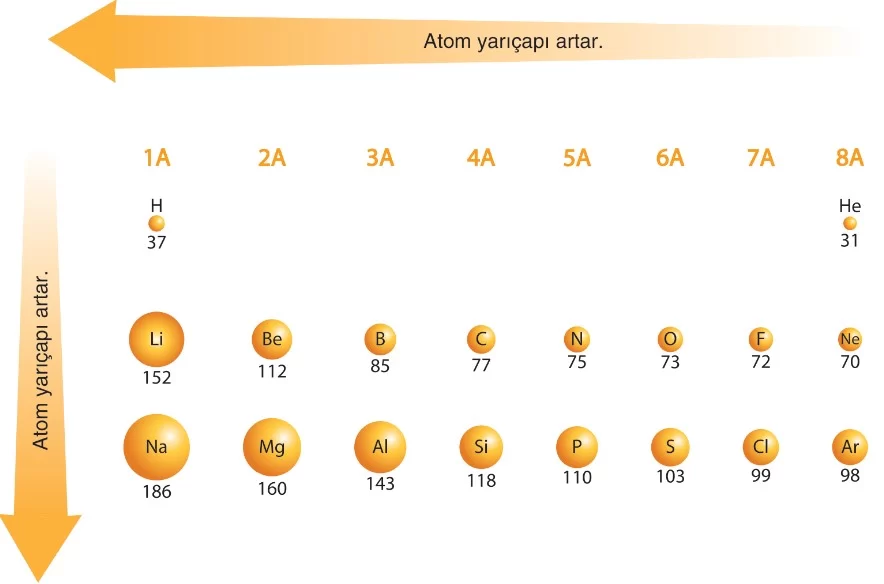
Periyodik sistemde elementler artan atom numaralarına göre sıralanır. A grubu elementleri için periyodik özelliklerden bazılarının grup ve periyoda bağlı değişimleri aşağıda verilmiştir.
1. Atom Yarıçapı (r)
- Atomların küre şeklinde olduklarını düşünürsek, atomların yarıçapları büyüklükleri ile orantılıdır. Atom yarıçapı, atomun özellikleri hakkında bilgi verir. Aynı tür atomların çekirdekleri arasındaki mesafenin yarısı, o atomun yarıçapını verir.
Periyodik tabloda aynı periyotta soldan sağa doğru ilerledikçe, atomların çekirdek yükleri artar ancak enerji kabuk sayıları sabit kalır. Bu durumda, çekirdeğin çekim kuvveti artar ve elektronlar çekirdeğe daha yakın çekilir. Sonuç olarak, atom yarıçapı küçülür.
Periyodik tabloda aynı grupta yukarıdan aşağıya doğru ilerledikçe, atomların enerji kabuk sayıları artar. Bu artış, atomların daha büyük bir hacme sahip olmasına neden olur. Bu nedenle, atom yarıçapı grupta aşağıya indikçe artar.
Bir tanecik elektron verdiğinde yarıçapı küçülürken, elektron aldığında yarıçapı büyür. Proton sayısı değişmediği için taneciğin çekirdek çekim kuvveti değişmez.

İzoelektronik taneciklerde, çekirdek yükü büyük olan taneciğin yarıçapı daha küçüktür.
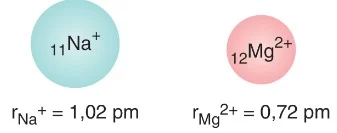
p/e oranı, birim elektron başına düşen çekim kuvvetini gösterir. Taneciğin p/e oranı ne kadar büyükse, yarıçapı o kadar küçüktür.
2. İyonlaşma Enerjisi
- Gaz hâlindeki nötr bir atomdan bir elektron koparmak için gerekli olan minimum enerjiye birinci iyonlaşma enerjisi denir. İE ile gösterilir. Bir atomdan elektron koparıldıkça p/e oranı artar ve elektronu koparmak için gerekli olan enerji miktarı da artar.
- İyonlaşma denklemleri:
- X(g) + İE₁ → X⁺(g) + e⁻ (İE₁: Birinci iyonlaşma enerjisi)
- X⁺(g) + İE₂ → X²⁺(g) + e⁻ (İE₂: İkinci iyonlaşma enerjisi)
İyonlaşma enerjileri arasında şu ilişki bulunur: İE₁ < İE₂ < İE₃ < … < İEₙ
Periyodik tabloda, aynı periyotta soldan sağa doğru gidildikçe elementlerin atom yarıçapları küçülür, buna karşın birinci iyonlaşma enerjileri genellikle artar.
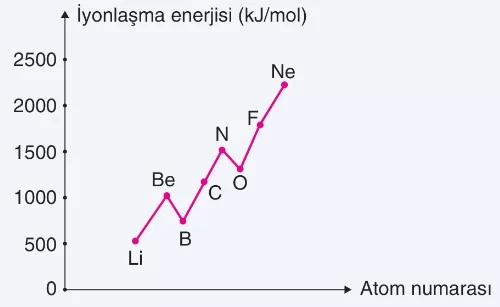
2A ve 5A grubu elementlerinin elektron dizilimleri küresel simetrik olduğu için, bu grupların birinci iyonlaşma enerjileri aynı periyotta 3A ve 6A gruplarına göre daha yüksektir. Bu nedenle, aynı periyotta iyonlaşma enerjileri sıralaması şu şekildedir:
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
Periyodik tabloda yukarıdan aşağıya doğru inildikçe, atomların enerji seviyeleri arttığından elektronlar çekirdekten daha uzak olur. Bu nedenle, elektron koparmak için gereken enerji azalır ve iyonlaşma enerjisi düşer.
En yüksek birinci iyonlaşma enerjisine sahip element helyumdur.
Ayrıca, soy gaz elektron diziliminde olan taneciklerden elektron koparıldığında iyonlaşma enerjisi 3,5 kat artar. Bu özellik sayesinde, bir elementin:
- Valans elektron sayısı
- Grup numarası
- Bileşik oluşturma eğilimleri tahmin edilebilir.
3. Elektronegatiflik
- Elektronegatiflik, bir atomun bağ elektronlarını kendine çekme gücünün büyüklüğüdür. Elektronegatiflik doğrudan ölçülemez.
- Linus Pauling, elementlerin elektronegatiflik değerlerini hesaplamış ve florun elektronegatiflik değerini 4,0 kabul ederek diğer elementlerin elektronegatifliklerini 0 ile 4,0 arasında derecelendirmiştir.
- Ametaller, dış enerji seviyelerinde çok az boş yer olduğu için elektron alarak tam dolu hale gelmeye çalışırlar. Bu yüzden elektronegatiflikleri yüksektir. Metaller ise daha az sayıda elektron tutabildikleri için elektron vermeye eğilimlidirler. Bu nedenle periyodik tabloda soldan sağa doğru gidildikçe elektronegatiflik artar.
- Periyodik tabloda yukarıdan aşağıya doğru inildikçe, çekirdekten uzaklaşan elektronlar çekim kuvveti tarafından daha az çekilir. Bu nedenle elektronegatiflik aynı grupta aşağı doğru inildikçe azalır.
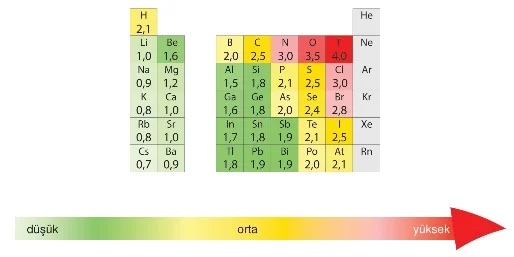
- Periyodik tabloda atom hacmi küçüldükçe iyonlaşma enerjisi artar, dolayısıyla elektronegatiflik de artar.
- Elektronegatifliği en yüksek olan element flor (F)’dur.
- Soy gazlar bağ oluşturma eğilimi göstermediği için elektronegatiflikleri yoktur.
- Elektronegatiflik, maddelerin özelliklerini anlamada önemli bir rol oynar:
- Bağların polarlık derecesi
- Moleküllerin polarlık/apolarlık özellikleri
- Bileşiklerin yükseltgenme basamakları
- Bileşiklerin iyonik ya da kovalent özellikleri

- Gaz halindeki nötr bir atomun elektron alırken ortaya çıkan enerji değişimine elektron ilgisi denir. Periyodik tabloda soldan sağa gidildikçe elektron ilgisi artar, yukarıdan aşağıya inildikçe azalır. Elektron ilgisi en yüksek olan element klordur (Cl).
- Metaller elektronlarını kolayca verebildikleri için metalik özellik gösterir. Aşağı indikçe metalik özellik artar.
- Ametaller elektron alarak soy gaz dizilimine ulaşmak isterler, dolayısıyla soldan sağa ve yukarıya doğru gidildikçe ametalik özellik artar.
Çözümlü Örnek Sorular:
Soru 1:
Aynı periyotta bulunan elementler arasında aşağıdaki özelliklerden hangisi soldan sağa doğru gidildikçe azalır?
A) İyonlaşma enerjisi
B) Elektronegatiflik
C) Metalik özellik
D) Elektron ilgisi
Çözüm:
Aynı periyotta soldan sağa doğru gidildikçe atomlar metalik özelliklerini kaybedip ametal özellik kazanmaya başlarlar. Metalik özellik soldan sağa doğru gidildikçe azalır. Diğer seçeneklerdeki özellikler ise genellikle artar.
Sonuç: C) Metalik özellik
Soru 2:
Aşağıdaki elementlerden hangisinin elektron ilgisi en yüksektir?
A) Oksijen (O)
B) Flor (F)
C) Klor (Cl)
D) Azot (N)
Çözüm:
Elektron ilgisi, bir atomun bir elektronu kendine çekme yeteneğidir. Periyodik tabloda sağa doğru gidildikçe ve yukarıya doğru çıkıldıkça elektron ilgisi artar. Flor (F), periyodik tablodaki en yüksek elektron ilgisine sahip elementtir.
Sonuç: B) Flor (F)
Soru 3:
Periyodik tablonun bir grubunda yukarıdan aşağıya inildikçe atom yarıçapı nasıl değişir?
A) Artar
B) Azalır
C) Sabit kalır
D) Önce artar sonra azalır
Çözüm:
Bir grupta yukarıdan aşağıya inildikçe her yeni periyotla birlikte atomun enerji seviyeleri artar, bu da atom yarıçapının büyümesine neden olur.
Sonuç: A) Artar
Soru 4:
Aşağıdaki element çiftlerinden hangisinde atom yarıçapı büyüklük sıralaması doğrudur?
A) Na > K
B) Mg > Ca
C) S > O
D) Cl > F
Çözüm:
Bir grupta yukarıdan aşağıya gidildikçe atom yarıçapı artar. Bu nedenle K, Na’dan büyüktür. Mg ve Ca karşılaştırıldığında, Ca’nın atom yarıçapı daha büyüktür. S, O’dan büyük atom yarıçapına sahiptir. Cl, F’den daha büyük atom yarıçapına sahiptir. Doğru sıralama Cl > F şeklindedir.
Sonuç: D) Cl > F
Soru 5:
Periyodik tablonun bir periyodunda soldan sağa gidildikçe aşağıdaki özelliklerden hangisi artar?
A) Metalik özellik
B) Atom yarıçapı
C) Elektronegatiflik
D) İyonlaşma enerjisi
Çözüm:
Periyodik tabloda soldan sağa doğru gidildikçe atomlar daha ametal özellik gösterir, yani elektronegatiflik ve iyonlaşma enerjisi artar. Metalik özellik ve atom yarıçapı ise azalır.
Sonuç: C) Elektronegatiflik