Molekül Polarlığı ve Apolarlığı 9. Sınıf Kimya Konu Anlatımı
9. Sınıf Molekül Polarlığı ve Apolarlığı Testleri
9. Sınıf Molekül Polarlığı ve Apolarlığı Ders notu
Moleküller, atomlar arasında oluşan kimyasal bağlar aracılığıyla meydana gelir. Bu bağlar, molekülün elektriksel özelliklerini ve etkileşimlerini belirler. Moleküllerin, bağ yaptıkları atomlar arasındaki elektron paylaşımına bağlı olarak polar veya apolar özellik gösterebilirler. Molekül polarlığı, bir molekülün elektrik yükünün dağılımını ifade eder ve kimyasal reaksiyonlardan çözünürlüğe kadar birçok kimyasal özelliği etkiler.
Moleküllerin Polar ve Apolarlığı
Molekülde elektron yük dağılımı simetrikse yani dipol moment (bileşke kuvvet) sıfırsa molekül apolardır. Dipol moment sıfırdan farklıysa yani yük dağılımı asimetrikse molekül polardır.
Molekülde merkez atom üzerinde ortaklanmamış elektron çifti varsa molekül polardır.
Aşağıdaki moleküller incelendiğinde
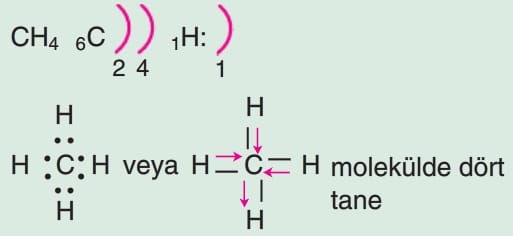
polar kovalent bağ olduğu görülür. Moleküldeki elektron yoğunluğu dengeli olduğundan dipol moment (bileşke kuvvet) sıfırdır. Dolayısıyla molekül apolardır.
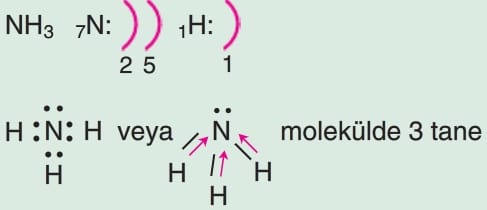
polar kovalent bağ vardır. Molekülde elektron yoğunluğu asimetrik olduğundan yani dipol moment sıfırdan farklı olduğundan molekül polardır.
Çözümlü Örnek Sorular
Soru 1:
H₂O molekülü hangi özelliğe sahiptir?
A) Apolar
B) Polar
C) İyonik
D) Metalik
Çözüm:
H₂O molekülü, oksijenin elektronegatifliğinin yüksek olması nedeniyle kutuplaşmış bir yapıya sahiptir. Bu nedenle su molekülü polar bir bileşiktir.
Sonuç: B) Polar
Soru 2:
CO₂ molekülünün yapısı nasıldır?
A) Polar
B) Apolar
C) İyonik
D) Metalik
Çözüm:
CO₂ molekülü doğrusal bir yapıdadır. İki oksijen atomu arasında simetrik bir dağılım olduğu için CO₂ molekülü apolar bir moleküldür.
Sonuç: B) Apolar
Soru 3:
CH₄ (metan) molekülü için aşağıdaki ifadelerden hangisi doğrudur?
A) Elektronegatiflik farkı yüksek olduğu için polar
B) Düzgün dörtyüzlü yapıya sahip ve apolar
C) Düzlemsel yapıya sahip ve polar
D) İyonik yapıya sahip
Çözüm:
CH₄ molekülü düzgün dörtyüzlü (tetrahedral) yapıya sahiptir ve hidrojen atomlarının simetrik dağılımı nedeniyle apolar bir moleküldür.
Sonuç: B) Düzgün dörtyüzlü yapıya sahip ve apolar
Soru 4:
NH₃ (amonyak) molekülü için hangi ifade doğrudur?
A) Apolar
B) Polar
C) Metalik
D) İyonik
Çözüm:
NH₃ molekülü üçgen piramidal bir yapıya sahiptir ve azot atomunun elektronegatifliği yüksek olduğu için molekül polar bir yapı gösterir.
Sonuç: B) Polar
Soru 5:
HCl molekülü için aşağıdakilerden hangisi doğrudur?
A) Polar
B) Apolar
C) İyonik
D) Metalik
Çözüm:
HCl molekülü, hidrojen ve klor atomları arasındaki elektronegatiflik farkı nedeniyle polar bir yapıya sahiptir.
Sonuç: A) Polar
Özet:
Molekül Polarlığı
Polarlık, bir moleküldeki elektronların eşit olmayan şekilde dağılması sonucu ortaya çıkar. Elektronegatiflik farkı büyük olan atomlar, bağladıkları elektronları kendilerine daha fazla çekerler. Bu durum, molekülde bir elektriksel dengesizlik yaratır ve molekülün bir tarafı daha negatif, diğer tarafı daha pozitif hale gelir. Böyle bir molekül polar molekül olarak adlandırılır. Polar moleküllerin belirgin özelliklerinden biri, su gibi polar çözücülerde iyi çözünmeleridir. Örneğin, su (H₂O) molekülü, oksijen atomunun daha elektronegatif olması nedeniyle polar bir moleküldür.
- Örnek: Su (H₂O), elektronların oksijen atomu tarafından daha fazla çekildiği için polar bir moleküldür. Oksijenin bulunduğu taraf negatif, hidrojenin bulunduğu taraf pozitif olur.
Molekül Apolarlığı
Elektronegatiflik farkı olmayan veya çok düşük olan atomlar arasında elektronlar eşit olarak paylaşılır. Bu durumda, molekülün her iki tarafında da elektriksel bir dengesizlik oluşmaz ve molekül apolar olur. Apolar moleküller genellikle simetrik yapıdadır ve bu nedenle polar bağlara sahip olsalar bile, molekülün toplam yük dağılımı dengeli olur. Apolar moleküller genellikle yağ gibi apolar çözücülerde iyi çözünürler.
- Örnek: Karbondioksit (CO₂), simetrik yapısı nedeniyle apolar bir moleküldür. Elektron paylaşımı simetrik olduğu için molekülün herhangi bir tarafında yük dengesizliği oluşmaz.
Molekül Polarlığının Önemi
Molekülün polar ya da apolar olması, kimyasal bağ yapma eğilimlerini, çözünürlüğünü ve diğer maddelerle etkileşimlerini doğrudan etkiler. Polar moleküller, polar çözücülerde çözünürken, apolar moleküller genellikle apolar çözücülerde çözünür. Bu durum, “benzer benzeri çözer” prensibi olarak bilinir ve kimyasal reaksiyonlarda önemli bir rol oynar. Polar moleküller arasında dipol-dipol etkileşimleri veya hidrojen bağları oluşurken, apolar moleküller arasında van der Waals kuvvetleri hakimdir.





bomba gibi olmus
Bugün sınav var, umarım anlamışımdır
hiçbir şey anlamadım
anlayamadım biraz daha iyi anlatılabilir
Anladım teşekkürler