Moleküler Yapılı Bileşiklerin Adlandırılması 9. Sınıf Kimya
Moleküler yapılı bileşikler, kovalent bağlarla bir araya gelmiş iki veya daha fazla ametal atomundan oluşan bileşiklerdir. Bu bileşikler, ametal atomlarının elektron paylaşımı yaparak stabil bir yapı oluşturmasıyla meydana gelir. 9. sınıf kimya müfredatında moleküler yapılı bileşiklerin adlandırılması, atom sayıları ve yapılarına bağlı olarak belirlenir.
Moleküler Yapılı Bileşiklerin Adlandırılması
Moleküler yapıdaki bileşiklerin adlandırılabilmesi için Latince rakamların bilinmesi önemlidir. Bileşik formüllerinde genellikle daha az elektronegatif olan element önce yazılır. Adlandırmada, bu elementin sağ altındaki sayı, Latince bir ön ek olarak elementin adına eklenir. Daha elektronegatif olan elementin sağ altındaki sayı ise anion formundaki adına Latince ön ek olarak eklenir ve böylece adlandırma tamamlanmış olur.
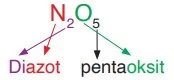
Örneğin, CO bileşiğinin sistematik adı “karbon monoksit” olarak adlandırılır. Burada, karbondaki “mono” ön eki basitlik amacıyla kullanılmaz. Ancak, ikinci element için “mono” ön ekinin kullanılması gerekir. Ayrıca, oksit adlarında “mono-“, “tetra-” veya “penta-” gibi önekler kullanıldığında, bu öneklerin sonundaki sesli harf düşer. Örneğin: monoksit, tetroksit, ve pentoksit şeklinde adlandırma yapılır.
Rakamların Latince Adları
| Rakam | Latince Adı |
|---|---|
| 1 | Mono |
| 2 | Di |
| 3 | Tri |
| 4 | Tetra |
| 5 | Penta |
| 6 | Hekza |
| 7 | Hepta |
| 8 | Okta |
Bazı bileşikler ise sistematik olarak adlandırılsa da geleneksel adları o kadar yaygınlaşmıştır ki, bu geleneksel isimler kullanılır.
Örnekler:
- H₂O : Su (dihidrojen monoksit)
- NH₃ : Amonyak (trihidrojen mononitrür)
Çözümlü Örnek Sorular
Soru 1:
Aşağıdaki bileşiklerden hangisinin doğru adı verilmiştir?
A) CO₂ → Karbon monoksit
B) H₂O → Dihidrojen oksit
C) NH₃ → Azot trioksit
D) SO₂ → Kükürt dioksit
Çözüm:
CO₂ karbon dioksit, H₂O su olarak bilinir ve yaygın adı bu şekildedir. NH₃ amonyaktır. SO₂ ise doğru olarak kükürt dioksit adlandırılır.
Sonuç: D) SO₂ → Kükürt dioksit
Soru 2:
N₂O bileşiğinin yaygın adı nedir?
A) Diazot monoksit
B) Azot oksit
C) Amonyak
D) Azot dioksit
Çözüm:
N₂O, iki azot atomu ve bir oksijen atomundan oluşan bir bileşiktir ve diazot monoksit olarak adlandırılır.
Sonuç: A) Diazot monoksit
Soru 3:
CO bileşiğinin adı nedir?
A) Karbon trioksit
B) Karbon dioksit
C) Karbon monoksit
D) Karbon tetraoksit
Çözüm:
CO, bir karbon ve bir oksijen atomu içerir ve bu nedenle karbon monoksit olarak adlandırılır.
Sonuç: C) Karbon monoksit
Soru 4:
PCl₅ bileşiği nasıl adlandırılır?
A) Fosfor pentaklorür
B) Fosfor triklorür
C) Pentaklor fosfit
D) Fosfat pentaklorit
Çözüm:
PCl₅ bileşiği, bir fosfor atomu ve beş klor atomundan oluşur. Bu bileşik fosfor pentaklorür olarak adlandırılır.
Sonuç: A) Fosfor pentaklorür
Soru 5:
Dihidrojen monoksit bileşiği yaygın olarak hangi isimle bilinir?
A) Amonyak
B) Su
C) Karbon dioksit
D) Metan
Çözüm:
Dihidrojen monoksit, H₂O formülüne sahip olan ve yaygın olarak su olarak bilinen bileşiktir.
Sonuç: B) Su
Özet:
Moleküler Yapılı Bileşiklerin Adlandırılması
Moleküler bileşikler, ametaller arasında oluşur ve bu bileşiklerin adlandırılmasında belirli önekler kullanılır. Bu önekler, bileşikteki atomların sayısını ifade eder.
- Mono: 1 atom
- Di: 2 atom
- Tri: 3 atom
- Tetra: 4 atom
- Penta: 5 atom
- Heksa: 6 atom
Moleküler yapılı bileşiklerin adlandırılma kuralları şunlardır:
- İlk elementin adı olduğu gibi yazılır.
- İkinci elementin adı, “-ür”, “-it” gibi son eklerle değiştirilir.
- Her iki elementin atom sayısı için uygun önekler kullanılır. İlk atom bir ise genellikle “mono” öneki kullanılmaz.
Örnek Adlandırma Kuralları
- CO (Karbon Monoksit): Karbon ve oksijen arasında kovalent bağ bulunur. Oksijen bir atom içerdiği için “mono” öneki kullanılır.
- CO₂ (Karbon Dioksit): İki oksijen atomu içerdiği için “di” öneki kullanılır.
- N₂O₄ (Diazot Tetraoksit): İki azot ve dört oksijen atomu içerir.
Moleküler Yapılı Bileşiklerin Yapısı
Moleküler bileşikler, kovalent bağlarla bir araya gelir ve bu bağlar, atomların değerlik elektronlarını paylaşarak oluşur. Kovalent bağlar, molekülü bir arada tutar. Molekülün yapısını Lewis yapısıyla göstermek mümkündür, burada atomlar arasındaki bağlar ve elektron paylaşımı net şekilde gösterilir.
Örnekler:
- Su (H₂O): Oksijen atomu iki hidrojen atomuyla kovalent bağ yapar. Oksijen, iki elektron çiftini hidrojen atomlarıyla paylaşarak bağ oluşturur.
- Metan (CH₄): Karbon atomu, dört hidrojen atomu ile bağ yapar ve her biriyle birer elektronunu paylaşır.
Çözümlü Sorular
Soru 1: N₂O bileşiğinin adını yazın.
Çözüm: N₂O, iki azot ve bir oksijen atomundan oluşur. Azotun sayısı “di” öneki ile belirtilir. Oksijen tek atom olduğundan “monoksit” olarak adlandırılır. Bileşiğin adı “Diazot Monoksit”tir.
Soru 2: PCl₅ bileşiğinin adını yazın.
Çözüm: PCl₅, bir fosfor (P) ve beş klor (Cl) atomu içerir. Klorun sayısı “penta” öneki ile gösterilir. Bileşiğin adı “Fosfor Pentaklorür” olur.
Soru 3: CO₂ bileşiğinin adını yazın.
Çözüm: CO₂, bir karbon ve iki oksijen atomundan oluşur. Oksijenin sayısı “di” öneki ile belirtilir. Bileşiğin adı “Karbon Dioksit”tir.