Mol Kavramı ve Formül Bulma Kimya Ayt
MOL KAVRAMI VE FORMÜL BULMA
Mol Kavramı
Avogadro sayısı (6,02.1023) tane taneciğe 1 mol denir. Maddeleri oluşturan tanecikler;
- Atom
- Molekül
- İyon
Avogadro sayısı N, N0 ve NA gibi sembollerle ifade edilir.
NA tane atoma 1 mol atom denir.
> 1 mol Na atomu = 6,02.1023 tane Na atomu içerir.
NA tane moleküle 1 mol molekül denir.
> 1 mol H2 molekülü = 6,02.1023 tane H2 molekülü içerir.
> 1 mol CH4 molekü = 6,02.1023 tane CH4 molekülü içerir.
NA tane iyona 1 mol iyon denir.
> 1 mol Na+ iyonu = 6,02.1023 tane Na+ iyonu içerir.
> 1 Mol F– iyonu = 6,02.1023 tane F– iyonu içerir.
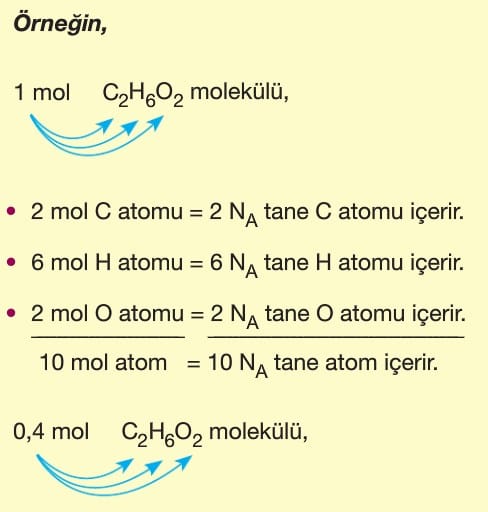
Tanecik sayısına göre mol sayısı hesaplanırken,
Moleküller en az iki tane ametal atomdan oluşan taneciklerdir. Molekülü oluşturan atomlar aynı veya farklı cinsten olabilir.
H2 ve O2 aynı cins atomlardan oluşan moleküller iken, CO2 ve H2O farklı cins atomlardan oluşan moleküllerdir.
Moleküldeki atomların mol veya tanecik sayıları hesaplanırken moleküllerin katsayıları dikkate alınır.
Mol Kütlesi (MA)
Avogadro sayısı (6,02.1023) tane atom veya molekülün kütlesi mol kütlesi olarak ifade edilir.
Örneğin; 12C atomu için,
- C’nin atom kütlesi 12’dir.
- 1 mol C atomu = 12 gram’dır.
- C’nin mol kütlesi = 12 g/mol’dür.
Örneğin; 16O atomu için,
- O’nun atom kütlesi 16’dır.
- 1 mol O atomu = 16 gram’dır.
- O’nun mol kütlesi: 16 g/mol’dür.
Molekül kütlesi hesaplanırken molekülü oluşturan atomların mol kütleleri toplanır.
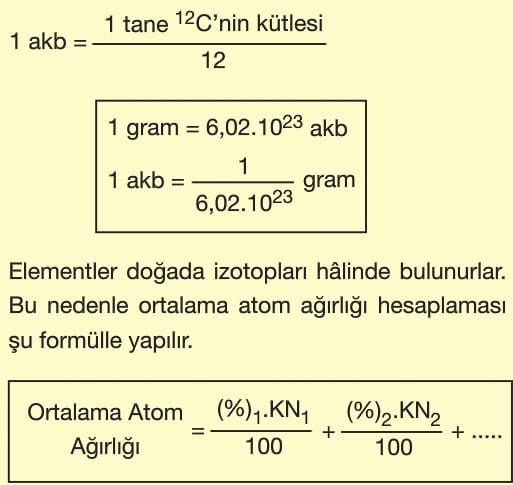
Bağıl Atom ve Bağıl Molekül Kütlesi
Bir elementin kütlesinin 12C’nin kütlesinin ![]() sine göre ne kadar büyük ya da ne kadar küçük olduğunu gösteren sayılara bağıl atom kütlesi denir.
sine göre ne kadar büyük ya da ne kadar küçük olduğunu gösteren sayılara bağıl atom kütlesi denir.
Örneğin;
- 1H’nin bağıl atom kütlesi 1’dir.
- 14N’nin bağıl atom kütlesi 14’tür.
- 16O’nun bağıl atom kütlesi 16’dır.
Bir molekülü oluşturan atomların bağıl atom kütleleri toplamına ise bağıl molekül kütlesi denir.
Gerçek Atom ve Gerçek Molekül Kütlesi
Bir elementi oluşturan atomlardan bir tanesinin gram cinsinden kütlesine gerçek atom kütlesi, moleküler yapıdaki bir maddeyi oluşturan moleküllerden bir tanesinin gram cinsinden kütlesine gerçek molekül kütlesi denir.
Formül Bulma
Bileşikler farklı oins atomlar içeren saf maddelerdir. Bileşiklerin formüllerini belirlemek için bileşiği oluşturan elementlerin mol sayılarının bulunması gerekir.
Bir bileşiği oluşturan elementlerin mol sayılarındaki oranı en küçük tam sayılarla gösteren formüle basit formül denir. NO, NO2, HNO3 ve CO2 basit formül örnekleridir.
Bir bileşiğin basit formülünü belirleyebilmek için,
1. Atomların molce birleşme oranı ya da
2. Elementlerin kütlece birleşme ve atom ağırlıkları oranları bilinmelidir. Basit formülle; bileşiği oluşturan elementlerin türü belirlenirken, bileşiğin fiziksel hâli ve bileşikteki atomların gerçek sayıları belirlenemez.
Bir bileşikteki atomların gerçek sayılarıyla birlikte gösterildiği formüle gerçek formül ya da molekül formülü denir. C6H6 ve C6H12O6 gerçek formül örnekleridir.
Bir bileşiğin molekül formülünü belirleyebilmek için,
1. Atomların molce birleşme oranı
2. Elementlerin atom ağırlıkları
3. Bileşiğin mol kütlesi
bilinmelidir. Molekül formülü; bileşiğin molce yüzde bileşimi ve mol kütlesi hakkında bilgi verirken bileşiğin fiziksel hâli hakkında kesin bir bilgi vermez.