Mol Kavramı 10. Sınıf Kimya
- Mol Kavramının Tarihsel Gelişimi
- Bağıl Atom Kütlesi
- İzotop Atomlar ve Ortalama Atom Kütlesi
- Mol Hesaplamaları
Bu yazımızda 10. sınıf kimya dersi Mol Kavramı konusunun ders notları ve konu anlatımı videoları bulunmaktadır. Konuyu bitirdikten sonra Mol Kavramı ile ilgili online testler çözebilirsiniz. Testler için aşağıdaki bağlantıya tıklayabilirsiniz.
10. Sınıf Mol Kavramı Testleri
Mol Kavramı Konu Anlatımı
Not: Sayfanın altında mol kavramı çözümlü soruları yer almaktadır. Ayrıca konu anlatımı videosunu da yine sayfanın sonunda bulabilirsiniz.
İnsanlar bazı maddeleri belirli adetle ifade etme yoluna giderek gündelik hayatta kolaylık sağlamıştır. Örneğin 1 deste kalem 10 tane kalemi belirtmektedir. 1 düzine bilye ise 12 tane bilyeyi belirtmektedir. Fakat çok küçük maddeler belirli amaçlar için kullanılmak istendiğinde bu kavramlar yetersiz kalmaktadır. Örneğin bir yapı firmasının istediği kum miktarını deste ile belirtmesi mantıksız ve pratikte uygulanabilir değildir. Aynı şekilde bir kimya laboratuvarında yapılacak deneyde kullanılan H2O adedinin düzine ile ifade edebilmek pek kullanışlı değildir.
Çok küçük tanelerden oluşan maddelerde özellikle bilimsel çalışmalarda bu sorunu aşmak için birim hacmindeki (1 cm3) tanecik sayısı genel olarak belirlenmek istenmiştir. Yapılan farklı çalışmaların tarihsel süreci sonucunda 6,02.1023 tane taneciği ifade eden bir kavram ortaya çıkmıştır. Bu kavram mol kavramıdır. 6,02.1023 sayısına Avogadroya itafen Avogadro sayısı adı verilmiştir. Ayrıca bu sayı 1 mol taneciği ifade etmektedir.
Nasıl ki 1 düzine 12 taneyi ifade ediyorsa 1 mol de 6,02.1023 taneyi ifade etmektedir. Avogadro sayısını her seferinde yazmak yerine NA sembolü ile ifade edebiliriz.
KRİTİK: Avogadro hipotezine göre aynı şartlar altında yani aynı sıcaklık ve basınçtan eşit hacim kaplayan gazlar eşit sayıda tanecik içerir. Bu hipotez 1 cm3 hacimde farklı maddeler için aynı sayıda tanecik bulunduğu düşüncesini desteklemiştir. Bu nedenle 6.02.1023 sayısına Avogadro sayısı adı verilmiştir.
MERAK: Avogadro sayısı 1 cm3 (birimi hacmindeki) tanecik sayısı olarak belirlendiği gibi karbon 12 izotopunun 12 gramında bulunan atom sayısı olarak da belirlenebilir. İki durumda da Avagadro sayısı yaklaşık olarak 6,02.1023 bulunur.
Mol Hesaplamaları
Atomik Kütle Birimi (Akb)


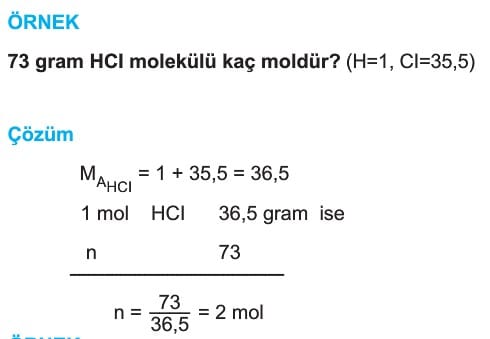
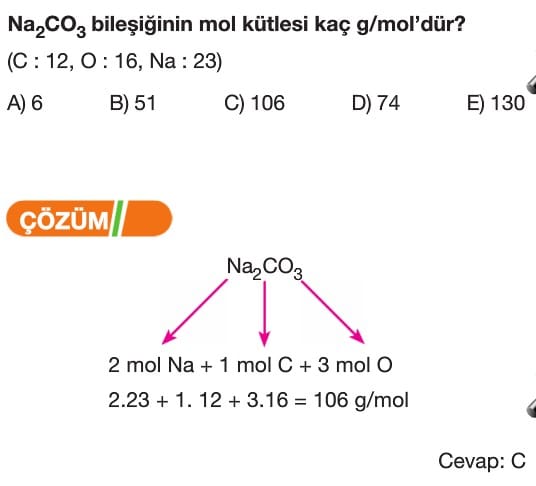
Herhangi bir maddenin 1 molünün kütlesine (Yani avogadro sayısı kadar adetine) mol kütlesi (mol ağırlığı) denir. mol kütlesi mA ile gösterilir.
Bir tane atomun veya molekülün kütlesinden yola çıkarak maddenin 1 molünün kütlesini yani mol kütlesini hesaplayalım.
1 tane 12C izotopunun kütlesinin 12 akb olarak kabul edildiğini biliyoruz. Buna göre 12C izotopunun mol kütlesini hesaplayalım.
1 tane 12C = 12 akb
1 mol (yani NA tane) 12C izotopunun kütlesine ulaşmamız gerektiğinden atom adetini NA ile çarpmalıyız. Dolayısıyla NA katına çıkmış olur.
Bağıl Atom Kütlesi
Atomların çok küçük yapıda bulunmasından dolayı kütlelerini hesaplayabilmek pek mümkün değildir. Bu nedenle bağıl atom kütlesi kullanılmaktadır. Herhangi bir atom kütlesinin karbon – 12 izotopunun kütlesiyle kıyaslanması sonucu elde edilen sayı o atomun bağıl atom kütlesidir. Yine karbon – 12 izotopu ile yapılan kıyaslama sonucu moleküler bileşikler için bağıl molekül kütlesi iyonik bileşikler için bağıl formül kütlesi hesaplanabilir. Örneğin oksijen atomunun bağıl atom kütlesi 16, H2O bileşiğinin bağıl molekül kütlesi 18, Ca(OH)2 bileşiğinin bağıl formül kütlesi 74’tür.
Ortalama Atom Kütlesi
Bir elementin atomlarının kütleleri birbirinden farklı olabilmektedir. Bu tür atomlara izotop atom denir. İzotop atomların aynı elemente ait olmalarına rağmen kütlelerinin birbirinden farklı olmasından dolayı ortalama atom kütlesi hesaplanma ihtiyacı doğmuştur. Bir elementin izotop atomlarının kütleleri ve doğada bulunma yüzdeleri dikkate alınarak ortalama atom kütlesi hesaplanır. Ortalama atom kütlesinin birimi akb dir.


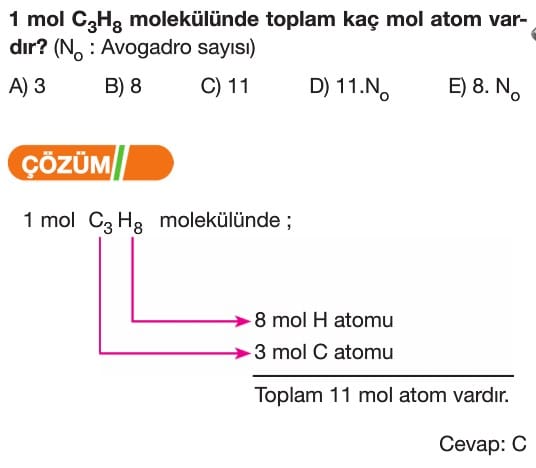
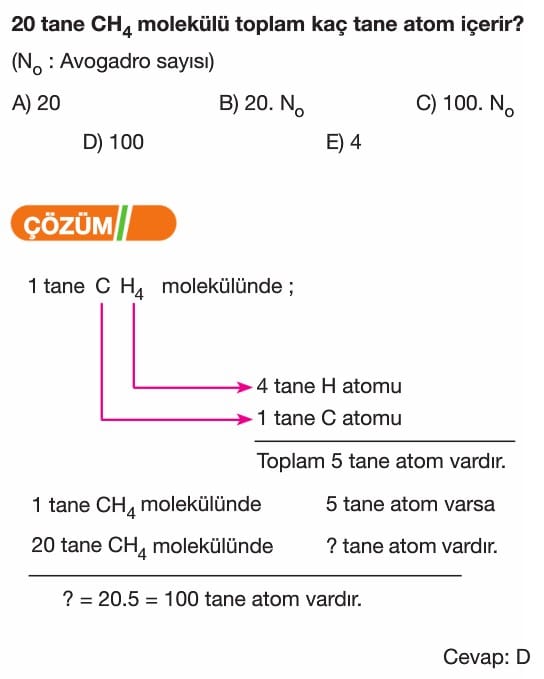
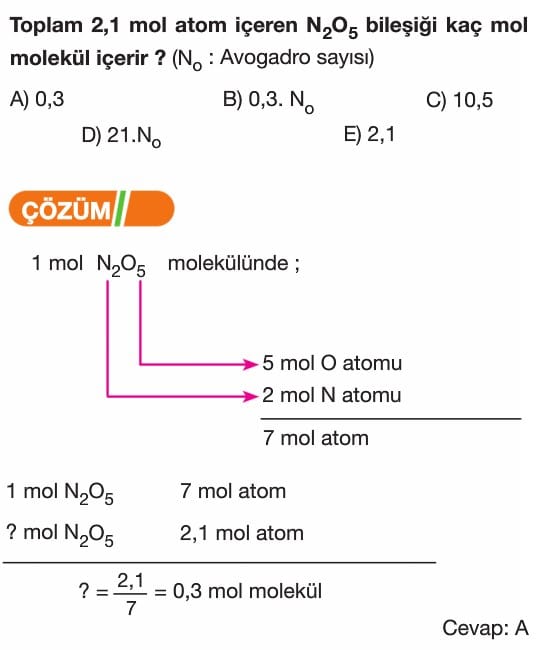
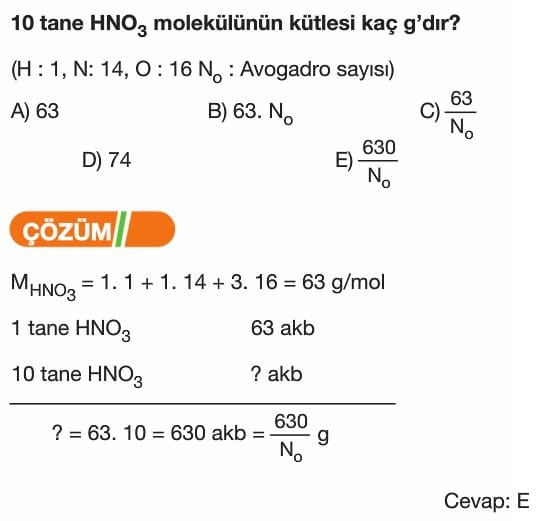
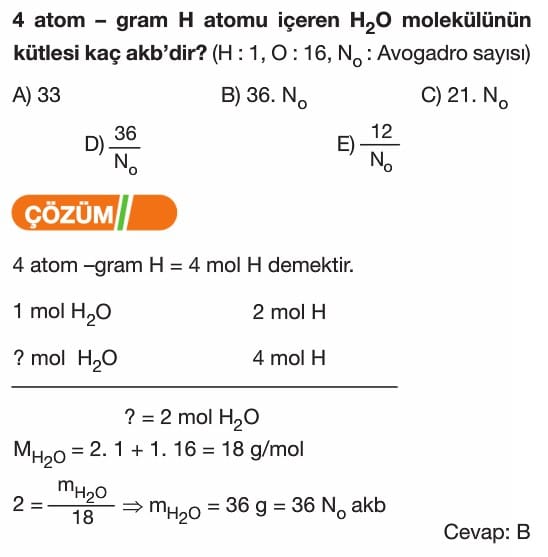
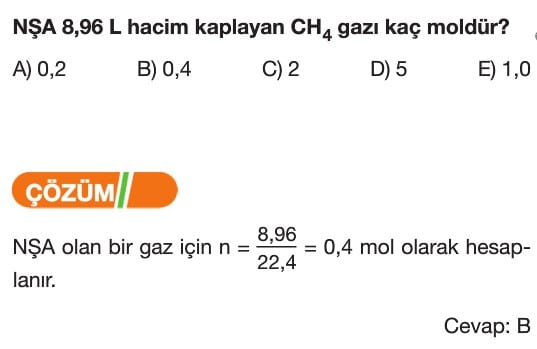
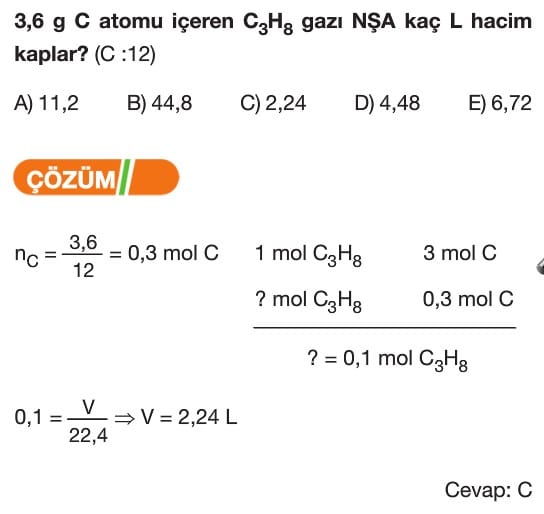
Mol Kavramı Soruları ve Çözümleri
KİMYANIN TEMEL KANUNLARI VE KİMYASAL HESAPLAMALAR
- KİMYANIN TEMEL KANUNLARI
a) Kütlenin Korunumu Kanunu
b) Sabit Oranlar Kanunu
c) Katlı Oranlar Kanunu - MOL KAVRAMI
- KİMYASAL TEPKİMELER VE DENKLEMLER
- KİMYASAL TEPKİMELERDE HESAPLAMALAR
Mol Kavramı Tonguç Akademi
Mol Kavramı 1 Kimya Adası
Mol Kavramı 2 Kimya Adası
Mol Kavramı 3 Kimya Adası
Kısa Özet
Mol kavramı, kimyada maddelerin miktarını ifade etmek için kullanılan temel bir ölçü birimidir. Bir mol, Avogadro sayısı olarak bilinen 6.02 x 10²³ tane atom, molekül ya da iyon içerir. Bu sayı, kimyasal tepkimelerde maddelerin miktarlarını doğru bir şekilde hesaplamamıza olanak sağlar. Mol kavramı, maddelerin kütle, hacim ve tanecik sayısı gibi özelliklerini anlamada önemli bir araçtır. Bir mol, maddenin molar kütlesi ile bağlantılıdır ve elementlerin periyodik tablodaki atom ağırlıklarına dayanır. Böylece mol, kimyasal hesaplamalarda kütle ve tanecik sayısı arasında köprü görevi görür.
Çözümlü Örnek Test Soruları
Mol Kavramı
- 1 mol su molekülünde kaç adet su molekülü bulunur?
A) 6.02 x 10²²
B) 6.02 x 10²³
C) 6.02 x 10²⁴
D) 6.02 x 10²⁵Çözüm: 1 mol herhangi bir maddenin içinde 6.02 x 10²³ adet tanecik bulunur. Bu sayı Avogadro sayısı olarak bilinir. Doğru cevap B‘dir. - 1 mol NaCl, kaç gramdır? (Na = 23 g/mol, Cl = 35.5 g/mol)
A) 23 g
B) 35.5 g
C) 58.5 g
D) 60 gÇözüm: NaCl’nin mol kütlesi (23 g/mol + 35.5 g/mol) = 58.5 g/mol. Dolayısıyla 1 mol NaCl 58.5 gramdır. Doğru cevap C‘dir. - 0.5 mol H₂O kaç gramdır? (H = 1 g/mol, O = 16 g/mol)
A) 9 g
B) 18 g
C) 36 g
D) 45 gÇözüm: H₂O’nun mol kütlesi 18 g/mol’dür. 0.5 mol H₂O = 0.5 * 18 = 9 g. Doğru cevap A‘dır. - 2 mol CO₂ gazının kaç litre hacim kapladığı kabul edilir? (STP koşullarında)
A) 11.2 L
B) 22.4 L
C) 44.8 L
D) 33.6 LÇözüm: STP (standart sıcaklık ve basınç) koşullarında 1 mol gaz 22.4 litre hacim kaplar. 2 mol CO₂ = 2 * 22.4 = 44.8 L. Doğru cevap C‘dir. - 0.25 mol oksijen gazı (O₂) kaç litre hacim kaplar? (STP koşullarında)
A) 5.6 L
B) 11.2 L
C) 22.4 L
D) 44.8 LÇözüm: STP koşullarında 1 mol gaz 22.4 L hacim kaplar. 0.25 mol = 0.25 * 22.4 = 5.6 L. Doğru cevap A‘dır. - 1 mol azot (N₂) kaç gramdır? (N = 14 g/mol)
A) 7 g
B) 14 g
C) 28 g
D) 42 gÇözüm: N₂’nin mol kütlesi 28 g/mol’dür (2 * 14 g/mol). Doğru cevap C‘dir.
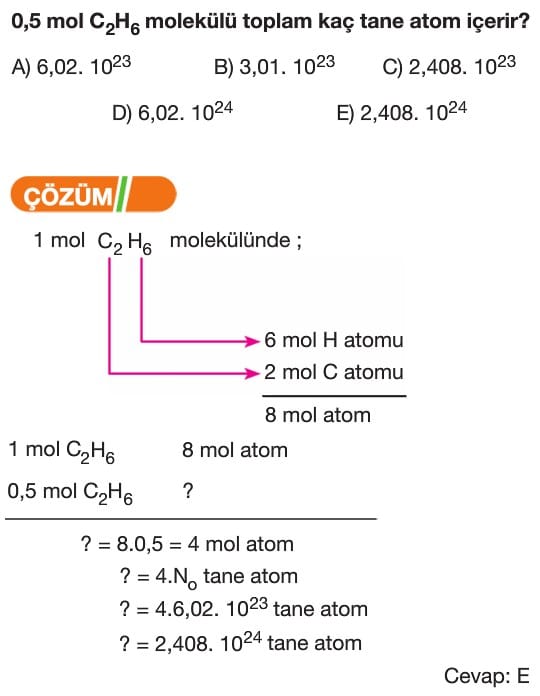
Soru : Bir kimyasal tepkimede 0.5 mol oksijen gazı (O₂) kullanıldığında, kaç tane oksijen molekülü (O₂) tepkimeye girmiş olur?
Çözüm: Mol sayısından tanecik sayısına geçmek için Avogadro sayısı kullanılır. 1 mol oksijen gazı = 6.02 x 10²³ molekül 0.5 mol oksijen gazı = 0.5 x 6.02 x 10²³ = 3.01 x 10²³ molekül oksijen tepkimeye girmiştir.
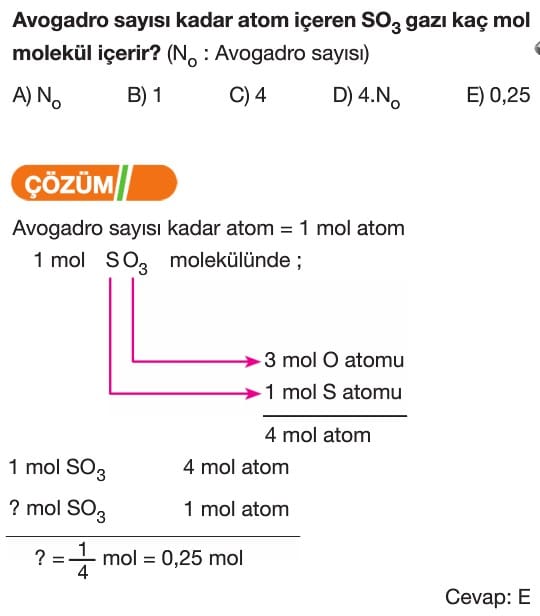
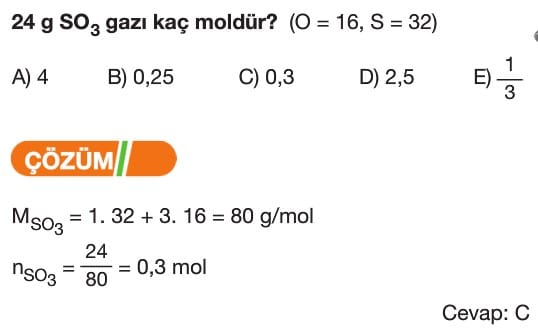
Soru : Karbon dioksit (CO₂) molekülünün molar kütlesi yaklaşık 44 g/mol’dür. 88 gram karbon dioksit gazı kaç mol içerir?
Çözüm: Mol sayısını bulmak için kütle ve molar kütle arasındaki ilişki kullanılır: Mol sayısı = Kütle / Molar kütle Mol sayısı = 88 g / 44 g/mol = 2 mol 88 gram karbon dioksit gazı 2 mol içerir.
Soru : 2 mol su (H₂O) molekülü kaç tane hidrojen atomu içerir?
Çözüm: Bir su molekülü 2 hidrojen atomu içerir. Önce su moleküllerinin sayısını hesaplayalım: 1 mol H₂O = 6.02 x 10²³ molekül 2 mol H₂O = 2 x 6.02 x 10²³ = 1.204 x 10²⁴ molekül Her molekül 2 hidrojen atomu içerdiğinden, toplam hidrojen atomu sayısı: 1.204 x 10²⁴ x 2 = 2.408 x 10²⁴ hidrojen atomu içerir.