Modern Atom Teorisi: Atom Modelleri Kimya Ayt
MODERN ATOM TEORİSİ
Dalga – Tanecik İkilemi
De Broglie bir fotonun enerjini hesaplayabilmek için Planck enerji bağıntısı ile Einstein’ın enerji formüllerini birlikte kullanarak taneciklerin dalga boyunu hesaplamaya yarayan formülü oluşturmuştur.
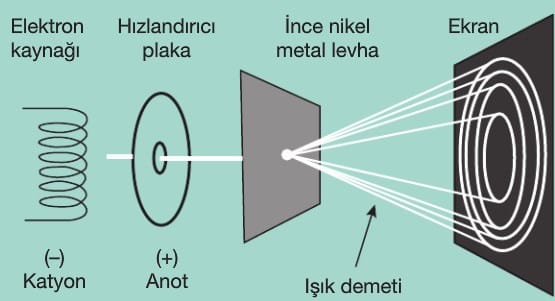
1927 yılında Davisson ve Germer bir elektron demetinin nikel bir kristal tarafından kırınıma uğradığını gözlemlemiştir. Buradan da maddenin dalga özelliğini ortaya atmışlardır.
Heisenberg’in Belirsizlik İlkesi
Heisenberg yaptığı çalışmalar sonucunda; ”Elektronların herhangi bir andaki konumu ve hızı aynı anda kesin olarak bilinemez.” şeklinde bir yargıya ulaşmıştır.
Atomun Kuantum Modeli
Bohr atom modelinde elektronlar yörüngelerde bulunur. Fakat bu model tek elektronlu tanecikleri açıklamayı başarırken çok elektronlu tanecikleri açıklayamamıştır. Schödinger ise elektronların yoğun olarak bulundukları bölgelere orbital adını vermiştir. Orbitaller aslında birer matematiksel fonksiyondur. Orbitallerin yerini ve durumunu belirtmek için de bazı kuantum sayıları kullanılır.
Bunlar;
Baş kuantum sayısı ( n ),
Açısal momentum (ikincil) kuantum sayısı (l),
Manyetik kuantum sayısı ( ml ),
Spin kuantum sayısı ( ms)’dir.
Baş Kuantum Sayısı (n): Elektronların bulundukları yörüngenin numarasıdır ve atomun enerji düzeylerini belirtir. 1, 2, 3, 4… gibi sıfırdan büyük tamsayılarla belirtilir. n değeri arttıkça potansiyel enerji de artar.
Açısal Momentum Kuantum Sayısı (l): Alt enerji düzeylerindeki elektron bulutlarının şekillerini ve buradaki enerji değişimini belirtir.
Sıfırdan (n-1)’e kadar olan sayıları ifade eder ve her sayıya karşılık gelen bir harf vardır.
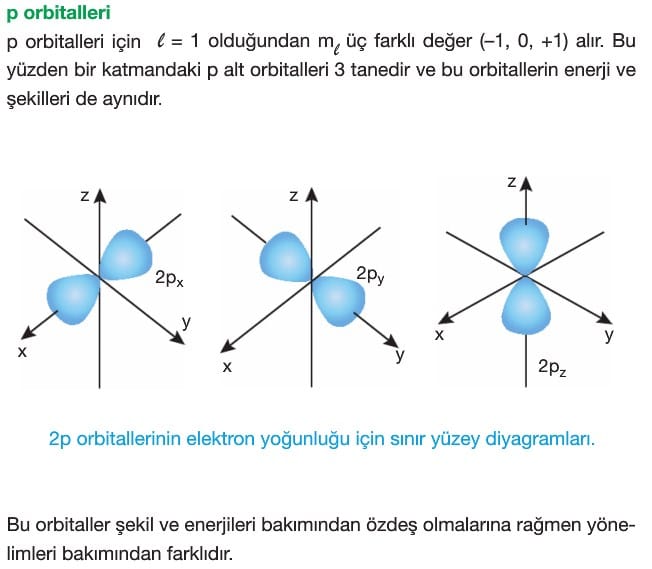
Manyetik Kuantum Sayısı ( ml): Orbitalin uzaydaki yönelimidir. Manyetik kuantum sayısı ikincil kuantum sayısına bağlıdır ve -l den +l ’ye kadar bütün tamsayı değerlerini alır.
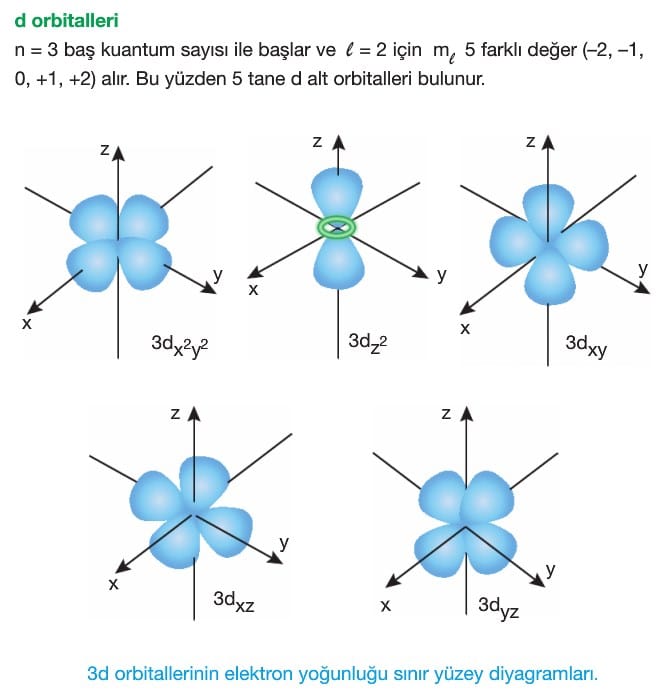
Orbital Türleri
OrbitaI elektronların bulunma olasılığının maksimum olduğu bölgelerdir ve s,p,d,f olmak üzere 4 çeşittir.
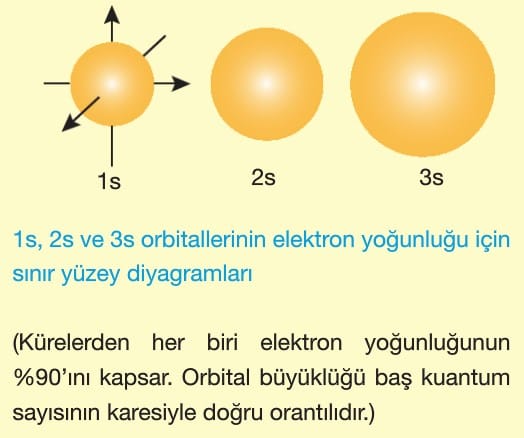
s orbitalleri
l = 0 değerine sahip tüm orbitaller s orbitalidir ve bütün katmanlarda 1 tane s orbitali vardır. s orbitallerinin büyüklüğü baş kuantum sayısı arttıkça artar.
Elektron Dağılımı
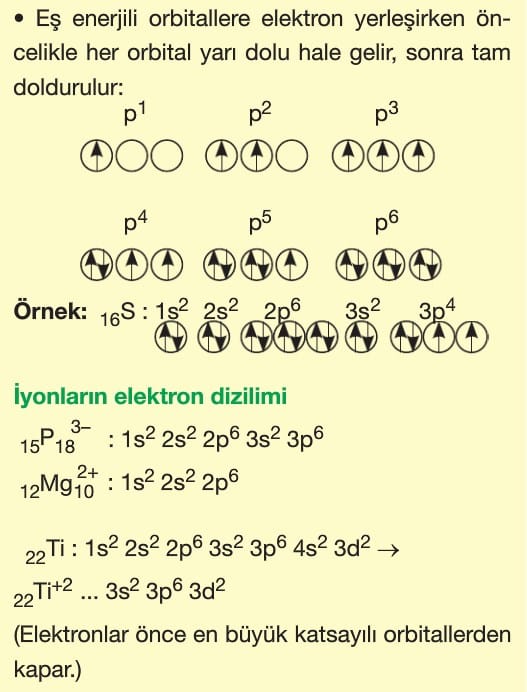
Atomlarda elektronların temel enerji seviyelerine göre alt enerji seviyelerine dağılımı ile ilgili 3 kural vardır.
Aufbau Kuralı: Elektronlar en düşük enerji seviyesinden başlanarak en yüksek enerji seviyesine doğru yerleşir.
Pauli İlkesi: Bir orbitale en fazla 2 elektron yerleşebilir. Pauli dışlama ilkesine göre bu elektronlar birbirlerine zıt yönde dönerler.
Hund Kuralı: Aynı temel enerji seviyesindeki eş enerjili orbitallere elektronlar önce birer birer yerleşir.