Metalik ve Ametalik Özellikler 9.Sınıf Kimya
Metalik ve Ametalik Özellikler
Metalik Özellikler:
- İyi iletkenlik: Metallerin elektrik ve ısıyı iyi ileten özelliklere sahip olmaları.
- Parlaklık: Metallerin yüzeylerinin parlak olması.
- Dövülebilirlik ve şekillendirilebilirlik: Metallerin dövülerek ince levhalar haline getirilebilmesi ve şekillendirilebilmesi.
- Ergime ve kaynama noktaları: Metallerin genellikle yüksek ergime ve kaynama noktalarına sahip olmaları.
Ametalik Özellikler:
- Kötü iletkenlik: Ametallerin genellikle elektrik ve ısıyı iyi iletememesi.
- Mat yüzey: Ametallerin yüzeylerinin mat olması.
- Kırılganlık: Ametallerin genellikle kırılgan olmaları ve kolayca kırılmaları.
- Düşük ergime ve kaynama noktaları: Ametallerin genellikle düşük ergime ve kaynama noktalarına sahip olmaları.
Elementlerin aktiflikleri reaksiyona girme eğilimleri ile ifade edilir. Reaksiyona girme eğilimi fazla olan elementler aktif, az olanlar ise pasif diye nitelendirilir.
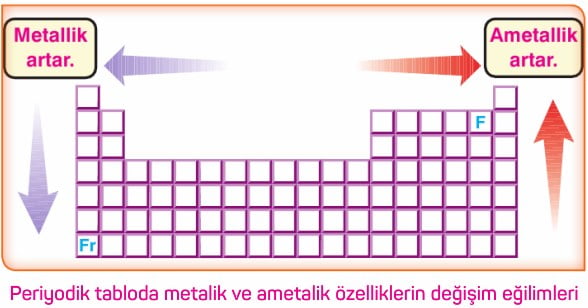
- Metallerin aktifliği, elektron verme kolaylığının bir ölçüsüdür. Periyodik tabloda sağdan sola ve yukarıdan aşağıya doğru metalik aktiflik (metalik özellik) artar.
- Ametallerin aktifliği, elektron alabilme kabiliyetinin bir ölçüsüdür. Periyodik tabloda soldan sağa ve aşağıdan yukarıya doğru ametalik aktiflik (ametalik özellik) artar.
Örnek
I. 1H ve 8O atomları arasında oluşan bağda elektronlar O atomu tarafından daha çok çekilir.
II. Cl nin elektronegativitesi 3,0 ve O nun elektronegativitesi 3,5 olduğuna göre, aralarında oluşan bileşikte O atomu negatif yüklü olur.
III. 16S ve 8O atomlarından S nin elektronegativitesi daha küçüktür.
Elektronegativite ile ilgili olarak yukarıdaki yargılardan hangileri doğrudur?
Çözüm: Elektronegativite temel olarak iki atom arasında oluşan bağdaki elektronlara atomların sahip çıkma yani onları çekme büyüklüğünün bir ölçüsüdür. Periyodik sistemde aynı periyotta sağa doğru, aynı grupta ise yukarı doğru gidildikçe elektronegativite artar. 1H ve 8O atomların hidrojenin elektronegativitesi, oksijenin elektronegativitesinden küçüktür. Bu nedenle aralarında oluşacak bağda oksijen atomu elektronları daha çok çeker. I. yargı doğrudur.
Oksijen atomunun elektronegativitesi, CI atomunun elektronegativitesinden büyüktür. Bu nedenle aralarında oluşacak bağda oksijen atomu elektronları daha çok çeker. Elektronları kendine daha çok çeken O atomu, elektron alan atom gibi davrandığı için yükü negatif olur. ll. yargı doğrudur.
16S ve 8O atomlarının ikisi de 6A grubundadır. Grupta daha yukarıda olan O atomunun elektronegativitesi, daha aşağıda olan S atomunun elektronegativitesinden daha büyüktür. III. yargı doğrudur. Cevap E