Maddenin Halleri ve Isı Alışverişi 8.Sınıf Fen
Yüzerken suyun sıvı haliyle, paten yaparken katı haliyle, soluk alıp verirken gaz haliyle karşılaşırız. Bu durumlar bize suyun üç farklı halde bulunabileceğini gösterir. Yaşamımızda hal değişimleri oldukça önemlidir. Bir maddenin hal değiştirmesi için maddenin ısı alması veya ısı vermesi gerekir. Maddelerin erirken ya da buharlaşırken aldıkları ısı miktarları her madde için farklıdır. Bu nedenle maddelerin erime – donma ve buharlaşma – yoğuşma ısıları ayırt edici birer özelliktir.
Katı haldeki bir maddenin ısı alarak sıvı hale geçmesine erime denir. Katı maddeler erirken çevresinden ısı alır. Çevreden alınan ısı, katı maddenin erime sıcaklığına gelmesi ve tamamen erimesi için kullanılır. Saf bir katı maddenin tamamı, katı halden sıvı hale geçinceye kadar sıcaklığında değişme olmaz. Bu sıcaklık değerine erime sıcaklığı denir. Katı maddenin erime sıcaklığına ulaştıktan sonra ısı almasına rağmen tamamen sıvı hale geçinceye kadar sıcaklığının artmamasının nedeni, alınan ısının maddeyi oluşturan taneciklerin tamamen birbirinden ayrılıp yeni bir düzene ulaşmasında kullanılmasıdır.
Erime sıcaklığındaki 1 g saf katı haldeki bir maddeyi aynı sıcaklıkta 1 g sıvı haline getirmek için gerekli ısıya erime ısısı denir. Erime ısısı, katı halde bulunan maddenin tanecikleri arasındaki çekim kuvvetlerinin azalmasına neden olur. Başka bir ifadeyle katı bir maddenin erimesi için sadece erime sıcaklığına kadar ısıtmak yeterli değildir. Bu sıcaklığa geldikten sonra, katı maddenin taneciklerinin, sıvı maddeyi oluşturan tanecikler gibi birbirinden uzaklaşması gerekir. Bu sebeple maddeye erime ısısı kadar enerji verilmelidir.
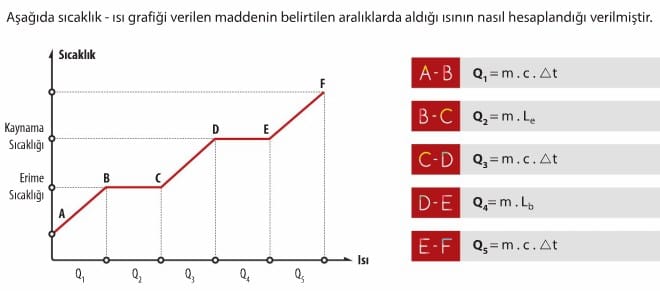
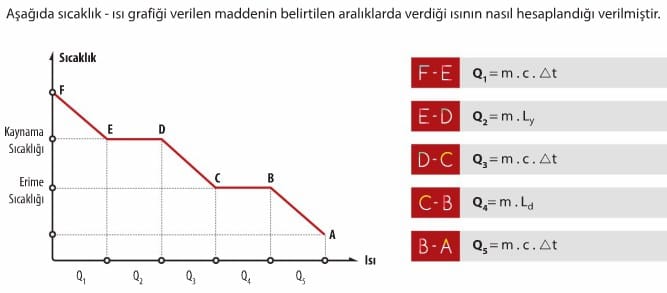
Erime ısısı Le ile gösterilir. Birimi J/g’dır. 0°C’deki 1 g buzun eriyerek 0°C’deki 1 g su haline gelmesi için buza 334,40 J enerji verilmesi gerekir. Erime sıcaklığındaki saf bir katı maddenin tamamının, aynı sıcaklıkta sıvı hale dönüşmesi için alması gereken ısı aşağıdaki eşitlikle hesaplanır.
m = Kütle
Le = Erime Isısı
Q = Maddenin Aldığı Isı
Sıvı haldeki bir maddenin ısı vererek katı hale geçmesine donma denir. Saf bir sıvı maddenin tamamı, sıvı halden katı hale geçinceye kadar sıcaklığında değişme olmaz. Bu sıcaklık değerine donma sıcaklığı denir. Erime ve donma birbirinin tersi olaylardır. Bu nedenle saf bir maddenin erime sıcaklığı, donma sıcaklığına eşittir. Donma sıcaklığındaki 1 g saf sıvı maddenin katı hale geçmesi için çevreye verdiği ısı miktarına donma ısısı denir.
Donma ısısı Ld ile gösterilir. Birimi J/g’dır. 0°C’deki 1 g suyun donarak 0°C’deki 1 g buz haline gelmesi için suyun 334,40 J enerji vermesi gerekir. Donma sıcaklığındaki saf bir sıvı maddenin tamamının aynı sıcaklıkta katı hale dönüşmesi için vermesi gereken ısı aşağıdaki eşitlikle hesaplanır.
m = Kütle
Ld = Donma Isısı
Q = Maddenin Verdiği Isı
Bir madde erirken ne kadar ısı alırsa aynı ısıyı donarken çevresine verir. Bu sebeple maddelerin donma ve erime ısıları birbirine eşittir.
Her madde erirken farklı miktarda ısıya ihtiyaç duyar. Çünkü maddelerin tanecikleri arasındaki çekim kuvvetinin etkisi maddeden maddeye değişir. Bu nedenle erime sırasında bu çekim kuvvetlerinin zayıflaması için harcanan enerji de her madde için farklı olur. Dolayısıyla erime ve donma ısısı saf maddeler için ayırt edici özelliklerdir. Aynı koşullarda, farklı maddelerin erime ve donma ısıları farklıdır.
Aşağıdaki kartlarda cıva, demir, bakır, buz, kurşun ve alüminyumun erime ve donma ısıları verilmiştir.
Erime ve donma ısıları büyük olan maddeler erirken çevrelerinden çok ısı alır, donarken çevrelerine çok ısı verir. Bir başka hal değişimi maddelerin sıvı hal- den gaz haline ve gaz halinden sıvı hale geçmesidir. Sıvı haldeki bir maddenin ısı alarak gaz haline geçmesine buharlaşma denir. Buharlaşma olayının gerçekleşmesi için ısıya ihtiyaç vardır. Sıvı buharlaşırken çevresinden ısı alır ve çevresini soğutur.
Sıvı maddeye ısı verildiğinde sıcaklık değeri kaynama sıcaklığına kadar artar. Sıvıların bundan sonra aldıkları ısı ise sıvının buhar haline geçmesi için harcanır. Buharlaşma sırasında sıvı maddeye aktarılan ısı, tanecikler arasındaki çekim kuvvetlerinin yok denecek kadar azalmasına ve taneciklerin bağımsız hale gelmesine sebep olur.
Kaynama sıcaklığındaki 1 g saf sıvıyı, aynı sıcaklıktaki 1 g buhar haline getirmek için gerekli ısıya buharlaşma ısısı denir. Buharlaşma ısısı Lb şeklinde gösterilir ve birimi J/g’dır. Kaynama sıcaklığındaki saf bir sıvı maddenin, tamamının aynı sıcaklıkta gaz haline dönüşmesi için alması gereken ısı enerjisi aşağıdaki eşitlikle hesaplanır.
m = Kütle
Lb = Buharlaşma Isısı
Q = Maddenin Aldığı Isı
Gaz halindeki bir maddenin ısı kaybederek sıvı hale geçmesine yoğuşma denir. Buzdolabından çıkarılan bir gazoz oda sıcaklığında bekletildiğinde, teneke kutunun etrafında su damlacıklarının oluştuğunu gözlemleriz. Bunun nedeni havadaki su buharının yoğuşarak sıvı hale dönüşmesidir. Buharlaşma ve yoğuşma birbirinin tersi olaylardır. Yoğuşma sıcaklığındaki 1 g saf buharın, aynı sıcaklıkta 1 g sıvı hale geçmesi için çevreye verdiği ısı
miktarına yoğuşma ısısı denir. Yoğuşma ısısı Ly şeklinde gösterilir ve birimi J/g’dır. Yoğuşma sıcaklığındaki saf bir gaz maddenin tamamının aynı sıcaklıkta sıvı hale dönüşmesi için vermesi gereken ısı enerjisi aşağıdaki eşitlikle hesaplanır.
m = Kütle
Ly =Yoğuşma lsısı
Q = Maddenin Verdiği Isı
Bir madde buharlaşırken ne kadar ısı alırsa, aynı ısıyı yoğuşurken çevresine geri verir. Kaynama sıcaklığındaki 1 g suyu aynı sıcaklıkta 1 g su buharı haline getirmek için suya verilmesi gereken ısı, kaynama sıcaklığındaki 1 g su buharının aynı sıcaklıkta 1 g su haline geçmesi için çevresine
verdiği ısıya eşittir. Dolayısıyla aynı madde için buharlaşma ısısı, yoğuşma ısısına eşittir.
Buharlaşma ve yoğuşma ısıları maddeler için ayırt edici özelliklerdir. Aynı koşullarda, farklı maddelerin buharlaşma ve yoğuşma ısıları farklıdır. Aşağıdaki kartlarda cıva, su, alkol, aseton, eter ve altının buharlaşma ve yoğuşma ısıları verilmiştir.
Maddelerin buharlaşırken çevreden ısı alması ve yoğuşurken çevreye ısı vermesinden yararlanılarak soğutucular yapılmıştır. Örneğin, buzdolaplarında soğutmanın gerçekleşmesi için bir kimyasal maddenin buharlaşması ve yoğuşması gerekmektedir. Bu kimyasal maddeye soğutucu denir. Elimize kolonya döktüğümüzde serinlik hissetmemizin, denizden ilk çıktığımızda üşümemizin nedeni sıvıların buharlaşırken vücudumuzdan ısı almasıdır. Aynı şekilde kesik karpuzu güneş ışığı alan bir yere bıraktığımızda karpuz soğur. Bunun nedeni karpuzdaki suyun buharlaşırken karpuzdan ısı almasıdır.
Sıvı halde bulunan soğutucu bir pompa yardımıyla buzdolabı içinde borularda dolaşır. Pompa bu olayı elektrik enerjisi yardımıyla gerçekleştirir. Buzdolabındaki besinlerin sıcaklığı borudaki sıvıdan daha yüksek olduğundan, besinlerden bu sıvıya ısı aktarılır ve sıvı buharlaşır. Bu olay buzdolabı içinde gerçekleştiğinden yiyecekler soğumuş olur. Gaz haline geçen soğutucu, borularla buz dolabının dışına gelir. Burada çevreye ısı aktarılması sonucu yoğuşma gerçekleşir ve soğutucu tekrar sıvı hale geçer. Aynı işlemler tekrarlandığı için buzdolabındaki yiyecekler soğur.
Sıcak yaz günlerinde etrafımızı suladığımızda ortamın serinlemesinin nedeni de suyun buharlaşırken ortamdan ısı alması ve ortamın sıcaklığının düşmesidir. Saf maddelerin erime – donma ve buharlaşma – yoğuşma sıcaklıkları sabittir. Saf maddelere farklı maddeler karışınca, bu karışımların erime – donma ve buharlaşma – yoğuşma sıcaklıkları değişir.
Buz, suyun donarak katılaşmış halidir. Sıvı haldeyken düzensiz hareket eden su molekülleri, donma sıcaklığında daha düzenli yapıda ve daha az hareketlidir. Suya tuz gibi farklı bir madde eklendiğinde tuzu oluşturan klor ve sodyum iyonları su moleküllerinin arasına girer ve su moleküllerinin düzenli bir yapı oluşturmasını geciktirir.
Böyle bir durumda, içinde tuz olan suyun donması için, sıcaklığın (atılan tuz oranına göre) 00C’nin altında bir değere inmesi gerekir. Yani saf olmayan maddelerin belirli bir donma sıcaklığı yoktur, donma olayı geniş bir sıcaklık aralığında gerçekleşir. Katkı maddeleri, sıvıların donma sıcaklığını düşürdüğünden, kışın yollardaki buzlanmayı önlemek için yollara tuz dökülür. Tuz atıldığında, suyun donma sıcaklığı O°C’den -15°Cye kadar düşebilir.
Hava sıcaklığı sıfırın altına düştüğünde araba hareketsiz iken soğutma suyu donabilir. Donduğunda genişler ve bulunduğu kabı çatlatabilir. Bunu önlemek için suya antifriz ilave edilir. Tüm sıvılarda olduğu gibi su molekülleri de düzensiz hareket eder. Katı maddelerde ise tanecikler düzenli yapıdadır ve bulundukları yerde hareket eder.
Su donarken önce taneciklerin hareketi yavaşlar ve düzenli bir hale geçer. Suya antifriz eklendiğinde ise antifriz molekülleri su molekülleri arasına girerek su moleküllerinin düzenli yapı oluşturup katı hale geçmesine engel olur. Kışın uçak pistleri alkol ile yıkanır. Bunun nedeni alkolün suyun donma sıcaklığını düşürerek buzlanmayı engellemesidir.
Sıvılara karışmış olan katkı maddeleri sıvının kaynama sıcaklığını yükseltir. Saf su 100°C de kaynarken içine farklı madde eklediğimizde kaynama sıcaklığı eklenen katkı maddesinin miktarına bağlı olarak yükselir. Yemek pişirilirken tuz yemek pişmeden önce atılır. Bunun nedeni suyun kaynama sıcaklığını yükselterek yemeğin daha çabuk pişmesini sağlamaktır.
Güneş ışığı alan bir yere bırakılan buz kalıbı, güneşten ısı alarak erir. Ocak üzerine konulan su ısı alır ve suyun sıcaklığı yükselir. Bir süre sonra su kaynamaya başlar. Su kaynarken hızlı bir şekilde sıvı halden gaz haline geçer. Bu olayların tersi de mümkündür. Su buharı, ısı kaybederse su haline gelir. Su, ısı kaybederse buz haline gelir.
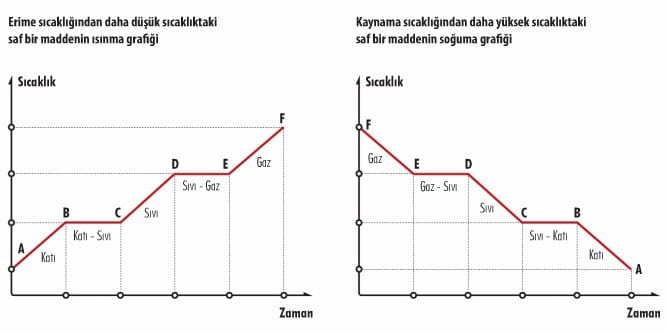
Hal değişimi sırasında maddelerin sıcaklıkları sabittir. Saf maddelerin belirli bir hal değişim sıcaklığı vardır. Bu sıcaklıklar maddeler için ayırt edici bir özelliktir. Erime sıcaklığından daha düşük sıcaklıktaki saf bir maddeye ısı verildiğinde sıcaklığı yükselir. Madde erime sıcaklığına ulaştığında erimeye başlar. Erime süresince ısı verildiği halde maddenin sıcaklığı değişmez.
Erime olayı tamamlandığında ısı verilmeye devam edilirse, maddenin sıcaklığı tekrar yükselmeye başlar. Madde kaynama sıcaklığına ulaştığında hızla
buharlaşmaya başlar. Buharlaşma olayı tamamlandığında ısı verilmeye devam edilirse, sıcaklık tekrar yükselmeye başlar. Maddenin fiziksel hali maddenin sıcaklığına bağlıdır. Maddenin sıcaklığı erime sıcaklığından düşük ise madde katı haldedir. Maddenin sıcaklığı erime sıcaklığına eşit ise madde katı ya da sıvı halde bulunabilir.
Maddenin sıcaklığı erime ve kaynama sıcaklıkları arasında ise madde sıvı haldedir. Maddenin sıcaklığı kaynama sıcaklığına eşit ise madde sıvı ya da gaz halinde bulunabilir. Maddenin sıcaklığı kaynama sıcaklığından yüksek ise madde gaz halindedir. Bir buz parçasının ısıtılarak önce su haline sonra da buhar haline getirildiğini düşünelim. Isı kaynağı yerine daha az ya da daha fazla ısı yayan bir kaynak kullanılsaydı taneciklerin düzenindeki değişim aynı kalırdı. Erime – kaynama sıcaklıkları ve erime – buharlaşma ısıları değişmezdi. Ancak erime ve kaynama süreleri değişirdi.
Buz parçasının miktarı daha az ya da daha fazla olsaydı yine taneciklerin düzenindeki değişim, erime – kaynama sıcaklıkları, erime – buharlaşma ısıları değişmezdi. Ancak erime ve kaynama süreleri değişirdi. Madde miktarları veya ısı kaynakları farklı olsa bile maddenin erime, donma, kaynama sıcaklıkları değişmez. Sadece erime, donma ve kaynama süreleri değişir.