Maddenin Fiziksel Halleri ve Gazların Özellikleri Kimya Tyt
Maddenin Fiziksel Halleri
1. Katı
2. Sıvı
3. Gaz
4. Plazma olarak sınıflandırılabilir. Ancak maddenin kararlı hali dediğimiz katı, sıvı ve gaz hali madde açısından çok sık karşılaştığımız bir durumdur. Maddelerin hallerini büyük ölçüde sıcaklık ve basınç belirler. Plazma hali genellikle maddenin çok yüksek sıcaklıktan etkilenmesi sonucu oluşturduğu atom, molekül, elektron, iyon karışımı bir yapıdır. Normal alev sıcaklığı 800 oC ile 5000 oC arasında bir plazma yapısıdır. Güneş ve yıldızlar plazma yapısındadır. Elektrik enerjisi yardımıyla soğuk plazma yapısı da oluşturulabilir.
Hayatın vazgeçilmezi olan su, basınç ve sıcaklığa bağlı olarak katı, sıvı ve gaz halinde bulunabilir. Yeryüzünde suların buharlaşıp tekrar yağmur ve kar olarak geriye dönüşümü bunun en iyi örneğidir.
Günlük hayatta kullandığımız LPG likit (sıvılaştırılmış) petrol gazı ve LNG likit (sıvılaştırılmış) naturel (doğal) gaz olarak bilinir.
Gazların Kinetik Teorisi
Gazların davranışını açıklayan teoridir.
Gaz molekülleri arasındaki boşluklar çok büyüktür. Bu bakımdan gaz molekülleri hacimleri ihmal edilebilen ancak kütleleri ihmal edilemeyen taneciklerdir.
Gaz molekülleri sürekli hareket halindedir. Hareketleri sırasında birbirleri ile ve kabın çeperleriyle çarpışırlar. Bu çarpışmalar esnek olup gazların yönleri ve hızları sürekli olarak değişir. Gaz tanecikleri doğrusal, gelişigüzel ve zikzaklı hareket ederler. (Brown hareketi)
Gaz molekülleri arasında itme ve çekme kuvvetleri yok kabul edilir.
Aynı sıcaklıkta gazın türüne bakmaksızın tüm gazların ortalama kinetik enerjisi birbirine eşittir. Sıcaklık arttıkça gazın ortalama kinetik enerjisi de artar.
Kinetik teori gazların özelliklerini açıklarken gaz moleküllerinin birbirini itip çekmediği, gazların öz hacimlerinin önemsiz olduğu gibi varsayımlarda bulunmuştur. Bu varsayımlara uyan gazlara ideal gaz denir. Tamamen ideal olan gaz yoktur, gazlar belirli koşullarda idealize yaklaşabilir.
Bir gaz:
- Düşük Basınç
- Yüksek Sıcaklık
- Geniş Hacim
- Düşük Mol Kütlesi
- Düşük moleküller arası çekim
Koşullarında idealliğe yaklaşır
İdeal gazın tersi gerçek gazdır. Gerçek gazların moleküller arası çekimi ideal gazlardan fazladır bu nedenle manometre ile ölçülen basıncı denklemler ile hesaplanandan daha düşük çıkar.
Gazların Özelliklerini Belirleyen Nicelikler
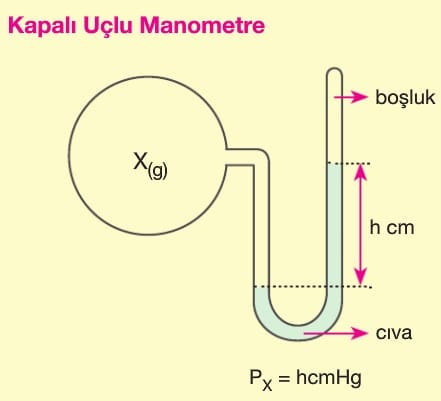
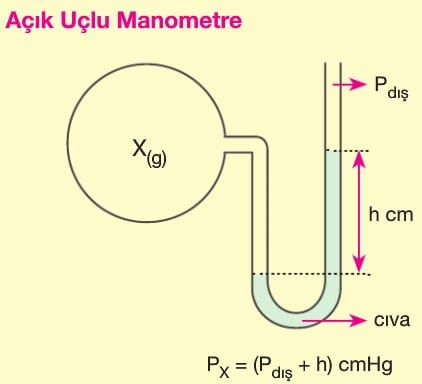
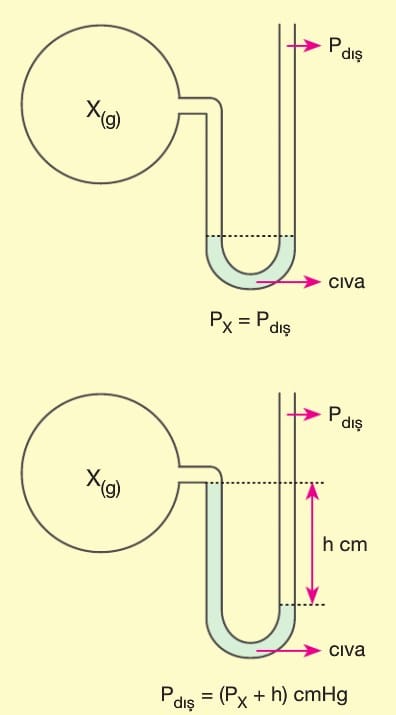
Basınç (P): Kinetik teoriye göre gazlar birbirlerine ve bulundukları kabın çeperlerine çarparlar. Bunun sonucu gaz basıncı oluşur. Kapalı kaptaki ‘gaz basıncını ölçen alete “manometre” denir.