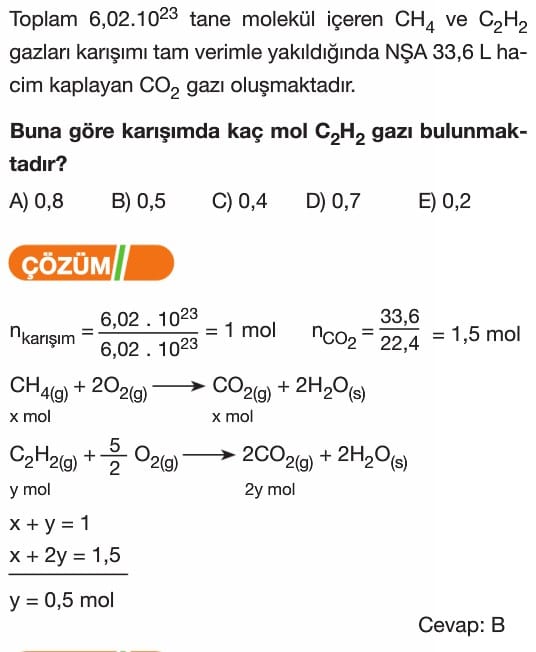
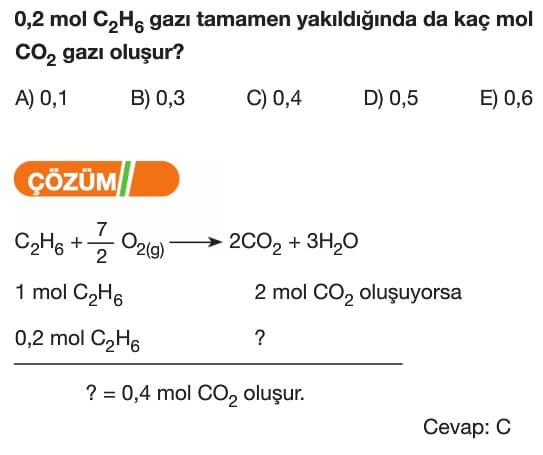
Kimyasal Tepkimelerde Hesaplamalar Soruları ve Çözümleri 10. Sınıf
Kimyasal Tepkimelerde Hesaplamalar – 10. Sınıf Çözümlü Sorular
Kimyasal tepkimelerde hesaplamalar, bir kimyasal reaksiyonda tepkimeye giren maddelerin ve ürünlerin miktarlarının hesaplanmasına dayanır. Mol kavramı, molar kütle, mol sayısı ve denklemlerle ilgili hesaplamalar bu konuda önemlidir. Aşağıda bu konuyla ilgili çözümlü sorular verilmiştir.
Soru 1:
2H₂ + O₂ → 2H₂O tepkimesinde 4 mol H₂ tepkimeye girdiğinde kaç mol H₂O oluşur?
A) 2 mol
B) 4 mol
C) 6 mol
D) 8 mol
E) 10 mol
Çözüm:
Verilen denkleme göre 2 mol H₂, 2 mol H₂O oluşturur. Bu durumda, 4 mol H₂ tepkimeye girerse, 2 katı kadar H₂O oluşur.
4 mol H₂ → 4 mol H₂O oluşur.
Cevap: B
Soru 2:
C + O₂ → CO₂ tepkimesinde 12 gram C tepkimeye girdiğinde kaç gram CO₂ oluşur? (C: 12 g/mol, O: 16 g/mol)
A) 22 gram
B) 32 gram
C) 44 gram
D) 56 gram
E) 64 gram
Çözüm:
Verilen tepkimede karbonun molar kütlesi 12 g/mol’dür. 12 gram C, 1 mol C’ye karşılık gelir. O₂’nin molar kütlesi 32 g/mol, CO₂’nin molar kütlesi ise 44 g/mol’dür.
1 mol C tepkimeye girerek 1 mol CO₂ oluşturur. 1 mol CO₂’nin kütlesi 44 gramdır. Bu durumda 12 gram C tepkimeye girdiğinde 44 gram CO₂ oluşur.
Cevap: C
Soru 3:
2Na + Cl₂ → 2NaCl tepkimesinde 23 gram Na ile tepkimeye giren Cl₂’nin kütlesi kaç gramdır? (Na: 23 g/mol, Cl: 35.5 g/mol)
A) 17.75 gram
B) 35.5 gram
C) 47 gram
D) 71 gram
E) 88 gram
Çözüm:
Tepkimede 2 mol Na, 1 mol Cl₂ ile tepkimeye girer. Na’nın molar kütlesi 23 g/mol olduğuna göre, 23 gram Na, 1 mol Na’dır.
Bu durumda, 1 mol Na ile 0.5 mol Cl₂ tepkimeye girer. Cl₂’nin molar kütlesi 71 gramdır. 0.5 mol Cl₂’nin kütlesi 71 / 2 = 35.5 gramdır.
Cevap: B
Soru 4:
3H₂ + N₂ → 2NH₃ tepkimesinde 6 mol H₂ tepkimeye girerse, kaç mol NH₃ oluşur?
A) 2 mol
B) 3 mol
C) 4 mol
D) 5 mol
E) 6 mol
Çözüm:
Verilen denklemde 3 mol H₂, 2 mol NH₃ oluşturur. 6 mol H₂ kullanıldığında, bu miktarın iki katı kadar NH₃ oluşur:
6 mol H₂ → 4 mol NH₃ oluşur.
Cevap: C
Soru 5:
CaCO₃ → CaO + CO₂ tepkimesinde 100 gram CaCO₃ parçalanırsa kaç gram CaO oluşur? (Ca: 40 g/mol, C: 12 g/mol, O: 16 g/mol)
A) 28 gram
B) 44 gram
C) 56 gram
D) 72 gram
E) 84 gram
Çözüm:
CaCO₃’ün molar kütlesi:
Ca: 40 g/mol, C: 12 g/mol, 3 tane O: 3 . 16 = 48 g/mol
CaCO₃’ün toplam molar kütlesi: 40 + 12 + 48 = 100 g/mol
100 gram CaCO₃, 1 mol CaCO₃’e karşılık gelir. 1 mol CaCO₃, 1 mol CaO ve 1 mol CO₂ oluşturur.
CaO’nun molar kütlesi Ca: 40 g/mol ve O: 16 g/mol olduğuna göre, CaO’nun molar kütlesi 40 + 16 = 56 gramdır.
Bu durumda 100 gram CaCO₃ parçalandığında 56 gram CaO oluşur.
Cevap: C
Soru 6 (Yeni Nesil Soru):
Bir öğrenci laboratuvarda 2 mol H₂O’nun parçalanması sonucunda kaç litre O₂ gazı elde edileceğini hesaplamak istiyor. Standart koşullarda 1 mol gaz 22.4 litredir. Buna göre öğrenci kaç litre O₂ gazı elde eder?
A) 11.2 litre
B) 22.4 litre
C) 33.6 litre
D) 44.8 litre
E) 56 litre
Çözüm:
Tepkime: 2H₂O → 2H₂ + O₂
Bu tepkimede 2 mol H₂O parçalandığında 1 mol O₂ gazı elde edilir. 1 mol O₂ gazı standart koşullarda 22.4 litre hacim kaplar. Bu nedenle, öğrenci 22.4 litre O₂ gazı elde eder.
Cevap: B
Soru 7 (Yeni Nesil Soru):
Bir fabrikada, çelik üretiminde kullanılan demirin (Fe) oksijenle tepkimesi sonucu Fe₂O₃ oluşmaktadır. 2 mol Fe₂O₃ elde etmek için kaç mol Fe kullanılmalıdır? (Tepkime: 4Fe + 3O₂ → 2Fe₂O₃)
A) 2 mol
B) 3 mol
C) 4 mol
D) 6 mol
E) 8 mol
Çözüm:
Denklemde 4 mol Fe, 2 mol Fe₂O₃ oluşturur. 2 mol Fe₂O₃ elde etmek için 4 mol Fe gereklidir. Bu yüzden cevabımız 4 mol olacaktır.
Cevap: C
Kimyasal tepkimeler gerçekleşirken çevre ile ısı alışverişi meydana gelir. Gerçekleşirken çevreden ısı alan tepkimelere endotermik tepkime, çevreye ısı veren tepkimelere ekzotermik tepkime denir. Analiz tepkimeleri ve N2 gazının yanması olayları endotermik; diğer yanma olayları, nötrleşme ve sentez tepkimeleri ekzotermik tepkimelerdir.
KİMYASAL HESAPLAMALAR: Kimyasal olaylarda harcanan veya oluşan madde miktarlarının hesaplanmasına kimyasal hesaplama (stoklyometri) denir. Kimyasal hesaplama yapılırken,
1. Tepkime denklemi yazılır ve denkleştirilir.
2. Miktarı verilen maddenin mol sayısı hesaplanır.
3. Hesaplanan maddenin mol sayısından denklemdeki katsayılar yardımıyla miktarı istenen maddenin mol sayısına geçiş yapılır.
4. Safsızlık içeren maddelerin saf olan kısmı tepkimeye girer. Saf olan kısım mole çevrilerek hesaplama yapılır.
5. Tepkimeye giren maddelerden en az biri tamamen tükeniyorsa tam verimli tepkime gerçekleşir.
Sınırlayıcı Bileşen Soruları: Bir tepkimede tamamı harcanan ve oluşan madde miktarını belirleyen maddeye sınırlayıcı bileşen denir.
Verim Hesabı: Daha önce de bahsettiğimiz gibi bir tepkimeye giren maddelerden en az bir tanesi tükeniyorsa tam verimli tepkime gerçekleşir. Tepkime tam verimli değilse maddeler tepkimenin verimine göre harcanır ve oluşur.
Teorik Verim: Bir kimyasal tepkimede tepkimenin tam verimle gerçekleştiği kabul edilerek hesaplanan madde miktarıdır.
Gerçek Verim: Tepkimede oluşması beklenen değil gerçekte oluşan madde miktarıdır. Gerçek verimin daha düşük olması tepkimenin tam verimle gerçekleşmediği anlamına gelir. Bu tür tepkimelerde farklı etkenler verimin azalmasına yol açabilir. Tepkimenin denge halinde (çift yönlü yani tersinir) gerçekleşmesi, tepkimeye giren maddelerin safsızlık içermesi, tepkime sırasındaki madde kayıpları, tepkime esnasında ikinci bir tepkimenin daha gerçekleşerek reaktifleri kullanması gibi faktörler verimin % 100 olmamasının nedenleridir.