Kimyasal Tepkimeler 8.Sınıf Fen
Yeşil yaprakların sonbaharda kırmızı renge dönüşmesi sizce fiziksel bir olay mıdır? Hiç düşündünüz mü? Sarı renkli bir sıvıya saydam bir sıvı eklendiğinde şekildeki gibi kırmızı renk oluşmaktadır. Bu değişme fiziksel bir değişme olabilir mi? Bütan gazı ocağında yemek pişirilmesi sırasında gerçekleşen bütan gazının yanması, yemek karışımının ısınması, yemeğin pişmesi olaylarından hangileri fiziksel, hangileri kimyasal değişme olabilir? Bardağın kırılması kimyasal bir değişme olabilir mi? Mayalanan ekmek hamurunun kabardığını bilirsiniz. Hamurun kabarması sizce nasıl bir olaydır?
Kimyasal Tepkimeler
Kimyasal değişmelerde maddelerin iç yapılarında değişme olur. Bir kimyasal değişimin, değişime uğrayan ve sonuçta oluşan maddelerin sembol ya da formülleri ile girenler ve ürünler şeklinde ifadesine kimyasal denklem denir.
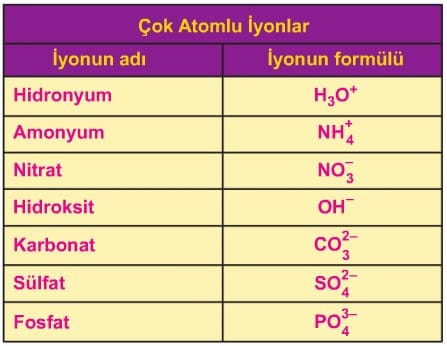
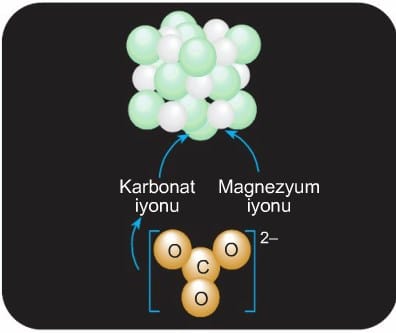
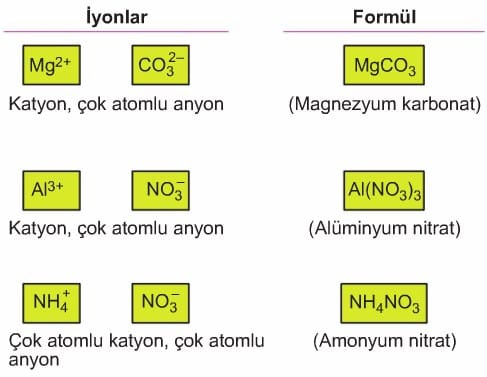
Çok atomlu iyonlar iki veya daha fazla sayıda element atomunun bir araya gelmesi sonucu oluşur. Çok atomlu iyonlarda anyon veya katyonun her biri, bir birim olarak ifade edilir. Bu birimde yer alan atomların toplam yükü çok atomlu iyonun yükünü oluşturur ve bu yük sağ üst köşede gösterilir. Örneğin; oksijen ve karbon atomlarından oluşan karbonat anyonu (CO3)2- bir birim olarak düşünülür ve bu iyon sağ üst köşede belirtildiği gibi iki negatif (2-) yüke sahiptir.
Çok atomlu iyonlar bileşik oluştururken yapılarını bozmadan diğer iyonlarla bir araya gelirler. Bu iyonların oluşturdukları bileşiklerde anyon ve katyonların yük denkliğini inceleyelim. Örneğin, çok atomlu anyona sahip olan magnezyum karbonat (MgCO3) bileşiğinde, her magnezyum katyonunun (Mg)2+ iki pozitif yükünü, iki negatif yük taşıyan bir karbonat anyonu (CO3)2- iyonları birebir oranda bir araya gelerek magnezyum karbonat (MgCO3) bileşiğini oluşturur.
Tepkimelerde Kütlenin Korunumu
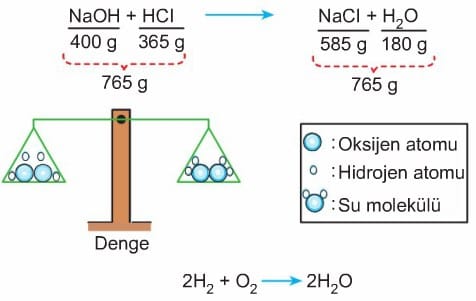
Bir kimyasal tepkime gerçekleştiğinde maddelerin kimyasal özellikleri değişir. Ancak değişmeyen bazı nicelikler ve özellikler vardır. Kimyasal değişmeler atomların elektron yapılarında olduğundan, çekirdek yapılarında yani atomların cins ve sayılarında bir değişim olmaz. Bu nedenle tepkimeden önceki toplam kütle ile tepkimeden sonraki toplam kütle eşittir. Buna, kütlenin korunumu kanunu denir.
14 g Fe tozu ile 8 g S tozu tartılarak karıştırılır ve ısıtılır. Elde edilen 22 g FeS’ün kütlesi Fe ve S kütlelerinin toplamına eşittir.
Tepkimelerde değişmeyen nicelikleri aşağıdaki gibi sıralayabiliriz.
- Atomların cins ve sayısı
- Toplam proton sayısı
- Toplam nötron sayısı
- Toplam elektron sayısı
- Toplam yük
- Toplam kütle
Basit Denklem Denkleştirme
Kimyasal tepkimelerde atomların cins ve sayılarının eşit olabilmesi için element ve bileşiklerin önüne bazı katsayılar yazılmalıdır. Katsayı 1 ise yazılmaz. Bu katsayılar element ya da bileşik ile çarpım durumundadır.
Kural:
- Denklemler eşitlenirken en küçük tamsayılar kullanılmaya çalışılır. Eğer kesirli sayı kullanılacaksa bileşiklerin ve tek atomlu elementlerin başına yazılamaz.
- Genellikle denklemdeki en kalabalık atom grubunun katsayısı 1 alınarak denklem denkleştirilmeye başlanır.
- H ve O atomlarının denkleştirilmesi en sona bırakılır.
- Atom eşitliğini sağlayacak katsayı daima bileşiğin veya molekülün baş tarafına yazılır. Bu katsayı bileşikteki her bir atomla çarpım durumundadır.
TEPKİME ÇEŞİTLERİ
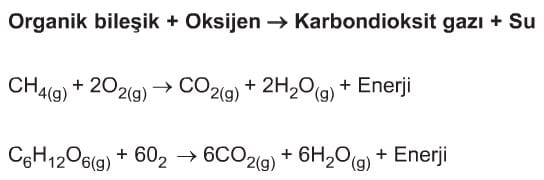
Yanma Tepkimesi: Bir maddenin oksijen gazı ile tepkimeye girmesine yanma denir. Yanma olayının olması için; yanıcı madde, oksijen ve tutuşma sıcaklığı gerekir. Yanma olayı, yavaş ve hızlı olmak üzere iki şekilde incelenebilir. Solunum olayı, demirin paslanması yavaş yanmadır. Mumun yanması, kağıdın yanması hızlı yanmadır. Akaryakıt yangınları; köpüklü yangın söndürücüler veya karbon dioksit bombaları ile söndürülebilir. Yapısında karbon, hidrojen ve oksijen bulunan organik bileşik yandığında karbon dioksit ve su oluşur.
- Yanma tepkimeleri, dışarı ısı veren bir tepkime çeşididir.
Kimyasal Tepkimelerin Önemi
Canlılık olaylarının sürdürülebilmesi için enerji gerekir. Bu enerji, canlı vücuduna alınan besinlerin sindirimi ve solunum olayları sonucu enerjiye dönüşmesi ile sağlanır. Örneğin vücuda alınan proteinler, enzimler aracılığıyla parçalanarak amino asitlere dönüştürülür. Amino asitler ince bağırsaklarda emilerek kana karışır. Kan yoluyla hücrelere taşınan amino asitler buralarda vücuda yararlı maddelere dönüştürülür. Bu nedenle kimyasal tepkimeler canlılığın devamı için ayrı bir önem taşır.
Tarımda kullanılan zirai mücadele ilaçları da kimyasal tepkimeler sonucu yapay olarak üretilir. Bitkilerin yapraklarında gerçekleşen ve kimyasal bir
değişme olan fotosentez olayı ile besin maddeleri ve oksijen üretilir. Oksijen gazı solunum olayında, besin maddeleri ise tüketici canlılar tarafından enerji kaynağı olarak kullanılır. Bu nedenle yaşamın sürekliliği fotosentez vb. kimyasal değişmelere dayanır. Sabun, deterjan, şampuan, gübre, şeker, naftalin, naylon, kâğıt, plastik, kauçuk, lastik gibi günlük yaşamda kullanılan maddeler kimyasal olaylar sonucu elde edilir. Örneğin beyaz sabun, bitkisel yağların sodyum hidroksit ile tepkimesinden elde edilir.
Örneğin iki maddenin birbirine katılması ile ısı açığa çıkar ya da yanma gözlemlenir. Bazı durumlarda ise gaz çıkışı gözlemlenebilir. Bu da bize etkileşen maddelerde bir kimlik değişimi olduğunu gösterir. Ayrıca; kimyasal tepkime gerçekleştiğini gösteren ipuçlarından biri renk değişimi ve çökelek oluşumudur.
ÇÖZÜMLÜ TEST SORULARI
Soru 1:
Aşağıdakilerden hangisi kimyasal değişime örnektir?
A) Buzun erimesi
B) Kağıdın yırtılması
C) Demirin paslanması
D) Suyun buharlaşması
Çözüm:
Paslanma yeni madde oluşumu gerektirir.
Cevap: C
Soru 2:
Kimyasal tepkimelerde aşağıdakilerden hangisi korunmaz?
A) Toplam kütle
B) Atom sayıları
C) Molekül şekilleri
D) Element türleri
Çözüm:
Moleküllerin şekli tepkimede değişebilir.
Cevap: C
Soru 3:
Hangisi ekzotermik tepkimeye örnektir?
A) Buzun erimesi
B) Fotosentez
C) Kömürün yanması
D) Suyun elektrolizi
Çözüm:
Yanma tepkimeleri ısı verir (ekzotermik).
Cevap: C
Soru 4:
2H₂ + O₂ → 2H₂O tepkimesi için hangisi söylenemez?
A) Oksijen yükseltgenmiştir
B) Hidrojen yanıcıdır
C) Su oluşmuştur
D) Yanma tepkimesidir
Çözüm:
Oksijen indirgenir, hidrojen yükseltgenir.
Cevap: A
Soru 5:
Katalizörler için hangisi doğrudur?
A) Tepkime sonunda miktarı azalır
B) Aktivasyon enerjisini yükseltir
C) Tepkime hızını değiştirmez
D) Tepkimeye girmez
Çözüm:
Katalizörler tepkimeye girmez, hızı artırır.
Cevap: D