Kimyasal Tepkimeler 8.Sınıf Fen Bilimleri
KİMYASAL TEPKİMELER
Maddelerin kimyasal değişime uğrayarak yeni maddelerin oluşması sürecine kimyasal tepkime denir. Kimyasal tepkime, kimyasal değişim ve kimyasal olay eş anlamlıdır. Canlılarda büyüme, sindirim, solunum, fotosentez gibi olaylar kimyasal tepkimeler sonucu gerçekleşir. Oluşan yeni madde, kendisini oluşturan maddelerden tamamen farklı özelliklere sahiptir.
Kimyasal tepkime gerçekleştiğinde maddeleri oluşturan atomlar yer değiştirir ve madde bir başka maddeye ya da maddelere dönüşür. Örneğin kömür yanarken kömürü oluşturan karbon (C) atomları, havadaki oksijen moleküllerinin (O2) atomlarıyla etkileşir ve atomlar yeniden düzenlenerek karbondioksit gazı (CO2) bileşiğini oluşturur. Bu durumu yazı ile kısaca aşağıdaki gibi ifade edebiliriz.

Elementlerin sembollerle, bileşiklerin formüllerle gösterildiği gibi kimyasal tepkimeler de kimyasal denklemlerle gösterilir. Diğer bir ifade ile kimyasal denklem; kimyasal tepkimelerin cümlelerle değil, sembol ve formüller kullanılarak ifade edilmesidir.
Yukarıda kömürün oksijen gazı ile tepkimeye girmesini yazı ile ifade etmiştik. Aynı kimyasal tepkimeyi sembol ve formül kullanarak denklem ile aşağıdaki gibi ifade edebiliriz.
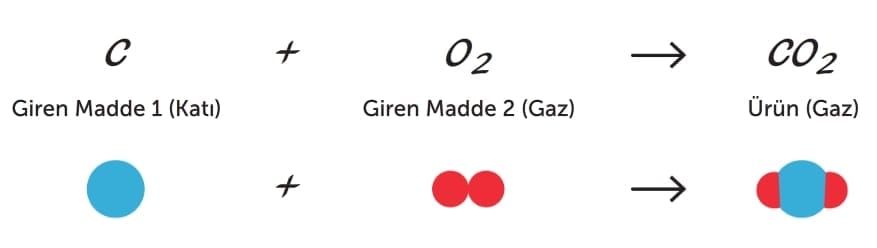
Buna göre önce tepkimeye giren daha sonra tepkime sonunda oluşan maddelerin kimyasal formülleri yazılır. Tepkime sonunda oluşan yeni maddeler ürün olarak adlandırılır. Giren maddelerin hangi ürünleri oluşturduğunu ifade etmek amacıyla ok işareti (→) kullanılır. Kimyasal denklemde tepkimeye giren maddeler okun sol tarafına, ürünler ise okun sağ tarafına yazılır. Kimyasal tepkimeye giren maddeler ve ürünler birden fazla ise aralarında “+” işareti kullanılır. Giren maddeler arasındaki “+“ işareti bu maddelerin birbiriyle tepkimeye girdiği; ürünler arasındaki “+“ işareti ise bu maddelerin tepkime sonucunda oluştuğu anlamına gelir.
Tepkimelerde Kütlenin Korunumu
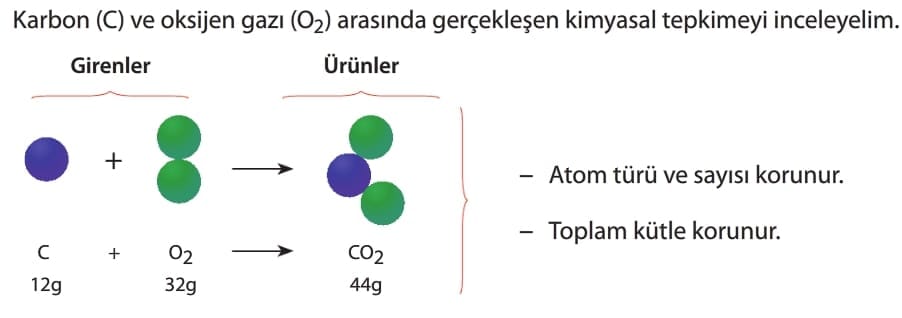
Bir kimyasal tepkime gerçekleştiğinde maddelerin kimyasal özellikleri değişir. Ancak değişmeyen bazı nicelikler ve özellikler vardır. Kimyasal değişmeler atomların elektron yapılarında olduğundan, çekirdek yapılarında yani atomların cins ve sayılarında bir değişim olmaz. Bu nedenle tepkimeden önceki toplam kütle ile tepkimeden sonraki toplam kütle eşittir. Buna, kütlenin korunumu kanunu denir.

Tepkimelerde değişmeyen nicelikleri aşağıdaki gibi sıralayabiliriz.
- Atomların cins ve sayısı
- Toplam proton sayısı
- Toplam nötron sayısı
- Toplam elektron sayısı
- Toplam yük
- Toplam kütle
Kimyasal tepkimelerde, değişime uğrayacak maddelere girenler, değişim sonucunda oluşan maddelere ürünler adı verilir.
Kimyasal tepkimelerin özellikleri aşağıdaki gibi sıralanabilir:
- Atomlar yok olmaz ve yeni atomlar oluşmaz. Yani atom türü korunur.
- Toplam atom sayısı değişmez.
- Toplam kütle korunur. Girenlerin toplam kütlesi, ürünlerin toplam kütlesine eşittir.
Yanma Tepkimeleri
Yanma olayları kimyasal değişimdir. Yanma olayları genellikle ısı ve ışık ortaya çıkan olaylar olarak düşünülür fakat bu durum, bütün yanma tepkimeleri için geçerli değildir. Demirin paslanması, gümüşün kararması, bakır levhanın renginin değişmesi gibi olaylar da yanma tepkimesidir.
Bir maddenin oksijen ile etkileşerek farklı bir maddeye dönüşmesine yanma tepkimesi denir.
Aşağıda bazı yanma tepkimelerinin denklemleri verilmiştir:

Tepkime denkleminin yanma tepkimesi olması için girenler tarafında oksijen molekülü (O2) olmalıdır.
Asit – Baz Tepkimeleri
Asit ve bazların karıştırılması sonucu kimyasal tepkime oluşur. Asit ve bazların etkileşerek tuz ve su oluşturması olayına nötrleşme (nötralleşme) tepkimesi denir.
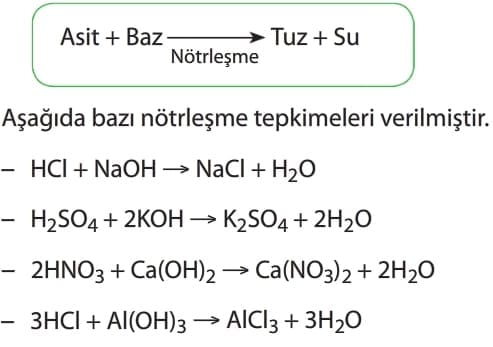
Nötrleşme tepkimeleri sonucunda ısı açığa çıkar.
Nötrleşme tepkimesinin özel bir örneği amonyak ile hidroklorik asitin karıştırılması sonucu oluşur.
HCI + NH3—> NH4CI
Bu tepkime sonucunda sadece tuz (NH4CI) oluşur, su oluşmaz. Bu nedenle NH4CI bileşiğine “susuz tuz“ da denir.