Kimyanın Temel Kanunları ve Kimyasal Hesaplamalar Soruları ve Çözümleri 10. Sınıf
10. sınıf kimya dersinin ilk ünitesi Kimyanın Temel Kanunları ve Kimyasal Hesaplamalar konudur. Bu ünite toplam 4 bölümden oluşmaktadır. Bunlar sırasıyla Kimyanın Temel Kanunları, Mol Kavramı, Kimyasal Tepkimeler ve Denklemler ve Kimyasal Tepkimelerde Hesaplamalar konularıdır. Bu yazımızda her bölüm için ayrı ayrı hazırlanmış çözümlü sorular bulunmaktadır. Dilerseniz aşağıdaki bağlantılara tıklayarak konu anlatımlarını da görebilirsiniz.
Kimyanın Temel Kanunları ve Kimyasal Hesaplamalar Konu Anlatımları
KİMYANIN TEMEL KANUNLARI ÇÖZÜMLÜ SORULAR
MOL KAVRAMI ÇÖZÜMLÜ SORULAR
KİMYASAL TEPKİMELER VE DENKLEMLER ÇÖZÜMLÜ SORULAR
KİMYASAL TEPKİMELERDE HESAPLAMALAR ÇÖZÜMLÜ SORULAR
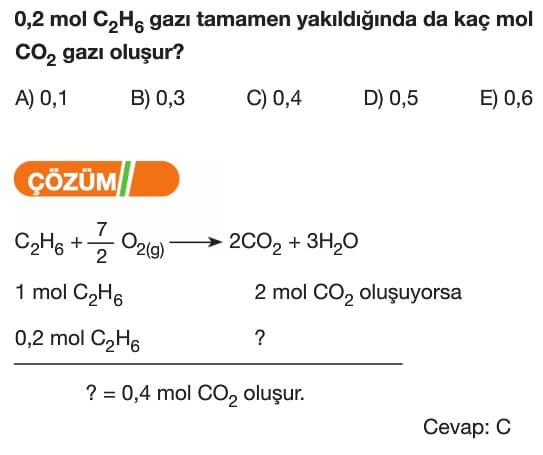
Çözümlü Test Soruları
Soru 1:
Aşağıdaki ifadelerden hangisi Kütlenin Korunumu Yasasını en iyi açıklar?
A) Kimyasal tepkimelerde ürünlerin kütlesi, tepkimeye girenlerin kütlesine eşittir.
B) Kimyasal tepkimelerde, ürünler sadece bir bileşikten oluşur.
C) Elementler tepkimelerde birbirine dönüşmez.
D) Kütle her zaman azalmaktadır.
E) Kimyasal tepkimelerde gazların hacmi daima sabittir.
Cevap: A (Kimyasal tepkimelerde ürünlerin kütlesi, tepkimeye girenlerin kütlesine eşittir.)
Çözüm: Kütlenin Korunumu Yasası, kimyasal tepkimelerde toplam kütlenin değişmediğini ifade eder.
Soru 2:
Bir kimyasal tepkimede 2 mol A ve 3 mol B kullanılarak 4 mol C ve 1 mol D elde edilmektedir. Bu tepkimenin denklemi aşağıdaki gibidir:
2A+3B→4C+D2A + 3B \rightarrow 4C + D
Bu tepkimede D‘nin mol sayısı kaçtır?
A) 1 mol
B) 2 mol
C) 3 mol
D) 4 mol
E) 5 mol
Cevap: A (1 mol)
Çözüm: Tepkime denklemi doğrudan verildiği için D’nin mol sayısı 1’dir.
Soru 3:
Aşağıdaki bileşiklerden hangisi molekül formülü ile tanımlanmıştır?
A) NaCl
B) H2O
C) CaCO3
D) Fe2O3
E) Na2SO4
Cevap: B (H2O)
Çözüm: H2O, suyun molekül formülüdür ve her molekül 2 hidrojen ve 1 oksijen atomu içerir.
Soru 4:
1 mol NaCl, kaç gramdır? (Na: 23 g/mol, Cl: 35.5 g/mol)
A) 58.5 g
B) 60.5 g
C) 62.5 g
D) 64.5 g
E) 66.5 g
Cevap: A (58.5 g)
Çözüm: NaCl = Na + Cl = 23 g/mol + 35.5 g/mol = 58.5 g/mol
Soru 5:
Hacim – Hacim ilişkisi ile ilgili aşağıdaki ifadelerden hangisi doğrudur?
A) Gazların hacmi, sıcaklığa bağlıdır.
B) Gazların hacmi, sadece basınca bağlıdır.
C) Gazların hacmi, sıcaklık ve basınç değişmezse sabittir.
D) Gazların hacmi, sadece miktara bağlıdır.
E) Gazların hacmi, maddenin durumuna bağlı değildir.
Cevap: C (Gazların hacmi, sıcaklık ve basınç değişmezse sabittir.)
Çözüm: Gazların hacmi, sıcaklık ve basınç koşullarına bağlı olarak değişir; bu nedenle bu ifade doğrudur.
Kimyasal Hesaplamalar Soruları
1. 2 mol su (H₂O) kaç gramdır? (H = 1 g/mol, O = 16 g/mol)
a) 18 g
b) 36 g
c) 32 g
d) 20 g
Cevap: b) 36 g
Çözüm: Su (H₂O) bileşiğinde 1 mol suyun molar kütlesi:
H₂O = 2 × H + O = 2 × 1 g/mol + 16 g/mol = 18 g/mol.
2 mol suyun kütlesi:
2 mol × 18 g/mol = 36 g.
2. 3 mol karbon dioksit (CO₂) kaç gramdır? (C = 12 g/mol, O = 16 g/mol)
a) 44 g
b) 88 g
c) 132 g
d) 66 g
Cevap: c) 132 g
Çözüm: Karbon dioksit (CO₂) bileşiğinin molar kütlesi:
CO₂ = C + 2 × O = 12 g/mol + 2 × 16 g/mol = 44 g/mol.
3 mol CO₂’nin kütlesi:
3 mol × 44 g/mol = 132 g.
3. 0.5 mol O₂ (oksijen) gazı kaç gramdır? (O = 16 g/mol)
a) 8 g
b) 16 g
c) 32 g
d) 48 g
Cevap: a) 8 g
Çözüm: Oksijen gazı (O₂) için molar kütle:
O₂ = 2 × 16 g/mol = 32 g/mol.
0.5 mol O₂’nin kütlesi:
0.5 mol × 32 g/mol = 16 g.
4. 0.25 mol NaCl (tuz) kaç gramdır? (Na = 23 g/mol, Cl = 35.5 g/mol)
a) 14.625 g
b) 11.5 g
c) 58.5 g
d) 23.4 g
Cevap: a) 14.625 g
Çözüm: NaCl bileşiğinin molar kütlesi:
NaCl = 23 g/mol + 35.5 g/mol = 58.5 g/mol.
0.25 mol NaCl’nin kütlesi:
0.25 mol × 58.5 g/mol = 14.625 g.
5. 1 mol C₆H₁₂O₆ (glukoz) kaç gramdır? (C = 12 g/mol, H = 1 g/mol, O = 16 g/mol)
a) 180 g
b) 90 g
c) 150 g
d) 120 g
Cevap: a) 180 g
Çözüm: C₆H₁₂O₆ bileşiğinin molar kütlesi:
C₆H₁₂O₆ = 6 × C + 12 × H + 6 × O
= 6 × 12 g/mol + 12 × 1 g/mol + 6 × 16 g/mol
= 72 + 12 + 96 = 180 g/mol.
Karışık Sorular
1. 0.5 mol su (H₂O) kaç tane su molekülü içerir?
a) 3.01 × 10²³
b) 6.02 × 10²³
c) 1.5 × 10²³
d) 2.5 × 10²³
Cevap: a) 3.01 × 10²³
Çözüm: 1 mol madde, 6.02 × 10²³ tane molekül içerir. O zaman 0.5 mol su:
0.5 mol × 6.02 × 10²³ = 3.01 × 10²³ tane su molekülü içerir.
2. 2 mol azot (N₂) molekülü kaç gramdır? (N = 14 g/mol)
a) 28 g
b) 56 g
c) 14 g
d) 42 g
Cevap: b) 56 g
Çözüm: Azot molekülü (N₂) için molar kütle:
N₂ = 2 × 14 g/mol = 28 g/mol.
2 mol N₂’nin kütlesi:
2 mol × 28 g/mol = 56 g.