Katılar ve Özellikleri 9. Sınıf Kimya Konu Anlatımı
9. Sınıf Katılar ve Özellikleri Testleri
9. Sınıf Katılar ve Özellikleri Ders Notu
Sıvı haldeki maddenin sıcaklığı düşürülerek daha düşük enerjili ve daha düzenli olan katı hal elde edilir.
Katıların,
- Belirli şekilleri vardır.
- Belirli hacimleri vardır.
- Maddenin en düzenli halidir.
- Tanecikler arası çekim kuvvetleri sıvı ve gaz haline göre daha büyüktür.
- Tanecikler arası boşluk yok denecek kadar azdır.
- Sıkıştırılamazlar.
- Maddenin enerjisi en düşük halidir.
- Tanecikleri yalnız titreşim hareketi yapar.
- Isı aldıklarında fiziksel özellikleri değişebilir.
Katı Türleri
Katılar tür bakımından ikiye ayrılır.
Amorf Katılar
Bu tür katılar sıkıştırılamaz ve sert olmalarına rağmen belirli geometrik şekilleri yoktur. Yumuşamanın başladığı sıcaklığa camsı geçiş sıcaklığı denir. O yüzden bu katılara şekilsiz anlamına gelen amorf katılar denir. Amorf katılarda tanecikler gelişi güzel dizilmiştir. Cam, lastik, plastik, tereyağı ve ruj bu tür katılara örnektir. Belirli bir erime ve kaynama noktaları yoktur.
Amorf katılar ısıtıldıklarında ilk olarak yumuşar daha sonra akıcılık kazanır. Yumuşamanın başladığı sıcaklığa camsı geçiş sıcaklığı denir. Yumuşak olduğu sıcaklık aralığında şekil verilip soğuma işlemine tabi tutulurlar. Bu sebeple amorf katıların bazılarına istenilen şekiller verilebilir.
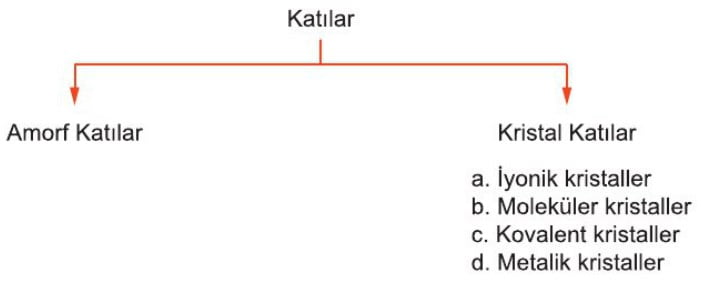
Kristal Katılar
Bu tür katılar sıkıştırılamaz, sert ve belirli geometrik şekilleri vardır. Kristal katıları oluşturan atom, iyon veya moleküller düzenli bir şekilde istiflenmiştir.
Tuz, şeker, elmas, naftalin, demir, bakır gibi katılar kristal katılara örnektir. Kristal katılar kararlıdır. Bu kararlılık tanecikler arası etkileşimlere
bağlıdır. Kristal katılar tanecikler arası etkileşimlerine göre,
a. İyonik kristaller
b. Moleküler kristaller
c. Kovalent kristaller
d. Metalik kristaller
olmak üzere 4’e ayrılır.
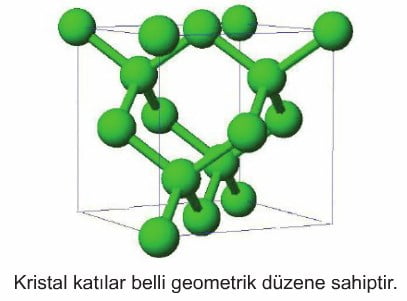
a. İyonik Kristal Katılar
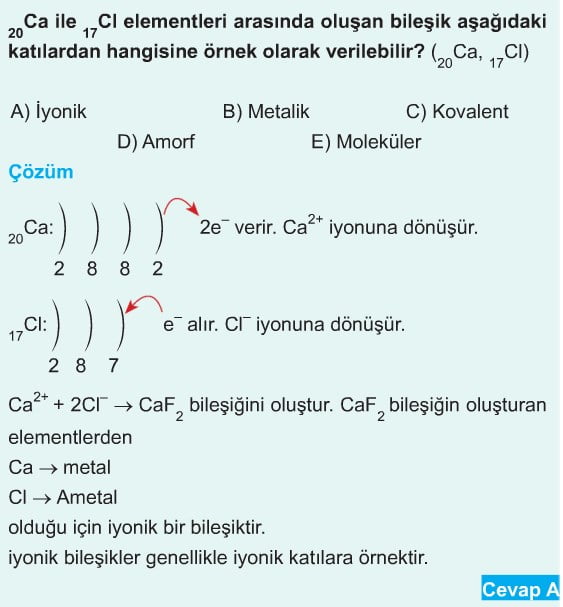
İyonlardan oluşan kristallerdir. İyonlar İyonik bağlarla bir arada bulunurlar. İyonların bir kısmı pozitif, bir kısmı negatif olduğundan, bu zıt yüklü iyonlar birbirini elektrostatik çekim kuvveti ile çekerler. Kristali oluşturan İyonların büyüklükleri (çapları) genellikle farklıdır. Bu farklılık iyonlar arası boşlukların oluşmasına neden olur. Bunun sonucunda iyonlar bu boşlukları doldurarak kristal yapıyı oluşturur.
İyonik Kristallerin Özellikleri
- İyonik kristaller sert, kırılgan ve yüksek erime-kaynama noktasına sahiptirler.
- Katı halde elektrik akımını iletmezler.
- Sıvı veya sulu çözeltileri elektrik akımını iletirler.
- Birim hücrelerden oluşurlar.
- Formül yapısına sahiptirler.
b. Moleküler Kristal Katılar
Örgü yapısını atom veya moleküllerin oluşturduğu kristallerdir. Moleküler kristallerdeki atom veya moleküller Van der Waals ve hidrojen bağları ile birbirine bağlanırlar. CO2, H2O, SO2, C12H12O11 ve I2 gibi katılar moleküler kristallere örnektir.
Kristalleri oluşturan molekül CO2 gibi apolar bir molekül ise moleküller arasında London kuvvetleri etkin güçtür. Kristalleri oluşturan molekül SO2 gibi polar bir molekül ise moleküller arasında dipol-dipol bağları etkin güçtür. Kristali oluşturan molekül H2O gibi hidrojen bağı oluşturabilen bir molekül ise moleküller arasında hidrojen bağı etkin güçtür. Güçlü etkileşimlerle (kovalent ve İyonik bağ) karşılaştırıldığında Van der Waals ve hidrojen bağları daha zayıftır. Bu sebepten erime ve kaynama noktaları düşük olup yumuşak yapılıdırlar.
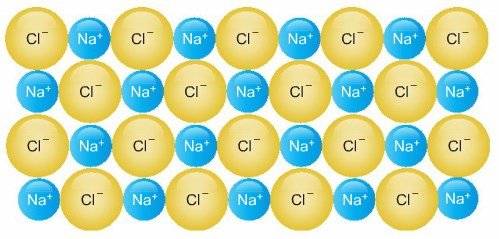
c. Kovalent Kristal Katılar
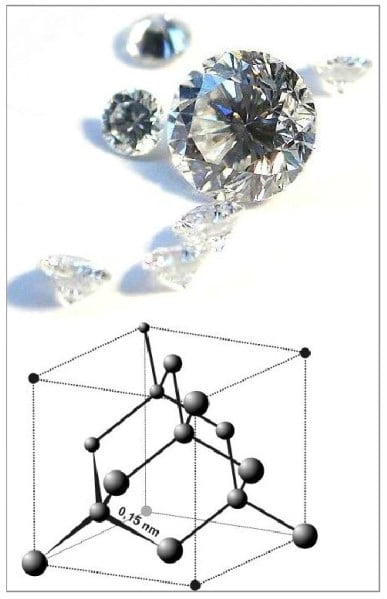
Bu katıların yapısındaki atomlar birbirine elektron ortaklaşması (kovalent bağ) ile tutunurlar. Elmas, grafit, bor ve kuvars (SiO2) kovalent kristallere örnektir. Karbonun iki allotropu olan elmas ve grafite bakıldığında karbon atomları uzayda farklı şekilde dizilmiştir. Elmasın yapısında, her karbon atomu diğer dört karbon atomuna bağlanarak düzgün dört yüzlü yapı oluşturmaktadır. Karbon atomları bu şekilde ve kuvvetli kovalent bağlar ile birbirlerine bağlandığı için elmasın çok sert ve yüksek erime noktasına sahip olmasını sağlar.
Grafitte karbon atomları geniş altıgen halkalar halinde düzenlenerek tabakalar oluşturmuşlardır. Bu tabakalar arasında Van der Waals bağları etkin güçtür. Bu yüzden grafit kolay kırılabilir. Ayrıca altıgen yapıda bulunan pi bağlarının rahat hareket etmesi sonucu grafit elektrik akımını iletir. Kovalent bağ örgüsünün sağlamlığından dolayı kovalent kristaller çok sert olup erime noktaları yüksektir. Bilinen en sert madde elmas olduğu için aşındırma ve kesme işlemlerinde kullanılır.
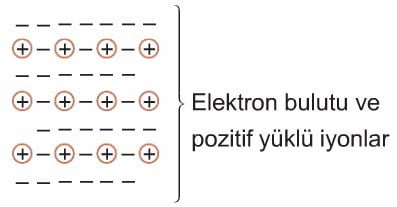
d. Metalik Kristal Katılar
Metaldeki değerlik elektronları, metal atomu tarafından kuvvetle tutunmadığından katı içerisinde serbestçe hareket edebilen elektron bulutu oluşturur. Bundan dolayı metal kristallerin bir elektron bulutu içerisinde düzenli bir şekilde bulunan pozitif yüklü İyonlardan oluştuğunu söyleyebiliriz. Pozitif yüklü iyonlar ile elektron bulutu arasındaki elektrostatik çekim kuvvetine metalik bağ denir.
Metalik bağın sağlamlığı değerlik elektron sayısı arttıkça ve çap küçüldükçe artar. Metalik bağın sağlamlığı metalik kristallerin sertlik ve dayanıklılığını belirler. Değerlik elektronlarının oluşturmuş olduğu elektron bulutunun serbestçe hareket edebilmesi metallerin ısıyı ve elektriği iyi iletmesini sağlar.
Tüm metal atomları metalik kristaldir.
Çözümlü Örnek Sorular
Soru 1
Aşağıdakilerden hangisi katıların özelliklerinden biri değildir?
A) Sabit bir şekle sahip olmaları
B) Sıkıştırılamaz olmaları
C) Moleküllerinin düzensiz bir yapıda olması
D) Belirli bir hacme sahip olmaları
Çözüm:
Katılar, sabit bir şekle ve belirli bir hacme sahip olup sıkıştırılamazlar. Ancak, moleküllerinin düzensiz bir yapıda olması sadece amorf katılar için geçerlidir; kristal katılarda ise düzenli bir yapı bulunur.
Doğru cevap: C
Soru 2
Katılarla ilgili olarak aşağıdaki ifadelerden hangisi yanlıştır?
A) Katılar sabit bir şekle sahiptir
B) Katılar sıkıştırılabilir
C) Katı molekülleri arasındaki çekim kuvvetleri çok güçlüdür
D) Katılar genellikle yüksek yoğunluğa sahiptir
Çözüm:
Katılar sıkıştırılamaz, bu nedenle “Katılar sıkıştırılabilir” ifadesi yanlıştır.
Doğru cevap: B
Soru 3
Aşağıdakilerden hangisi kristal katıların bir özelliğidir?
A) Düzensiz bir iç yapıya sahip olmaları
B) Belirli bir erime sıcaklığına sahip olmamaları
C) Belirli bir geometrik şekil oluşturmaları
D) Moleküllerin serbest hareket edebilmesi
Çözüm:
Kristal katılar düzenli bir iç yapıya ve belirli bir erime sıcaklığına sahiptirler. Molekülleri belirli bir geometrik şekil oluşturur.
Doğru cevap: C
Soru 4
Bir katının molekülleri arasındaki çekim kuvvetleri zayıfsa aşağıdaki durumlardan hangisi gözlenebilir?
A) Katı, sert ve kırılgandır
B) Katı, kolayca şekil değiştirir
C) Katı, belirli bir erime sıcaklığına sahiptir
D) Katı, yüksek yoğunluktadır
Çözüm:
Moleküller arasındaki çekim kuvvetleri zayıfsa, katı kolayca şekil değiştirir ve daha esnek olabilir.
Doğru cevap: B
Soru 5
Katılar hangi özellikleri nedeniyle sert ve dayanıklıdır?
A) Yüksek sıcaklıkta eriyebilmeleri
B) Moleküllerin serbest hareket etmesi
C) Moleküllerin sıkı ve düzenli bir yapıda olması
D) Düşük yoğunlukta olmaları
Çözüm:
Katılar, moleküllerinin sıkı ve düzenli bir yapıda olması nedeniyle sert ve dayanıklıdır.
Doğru cevap: C
Merak Kutusu: Belirli bir geometrik şekli ve kimyasal formülü olan doğal maddelere mineral, ekonomik değeri olan minerallere ise cevher veya filiz denir. Kristallerin büyüklüğü ve şekli, kristallenme ortamına ve kristallenme süresine bağlı olarak değişir. Süre uzadıkça kristalin boyutu da artar. Doğadaki jeolojik olaylar sonucu uzun yıllar boyunca oluşan mineraller bu yüzden büyüktür.












Ödevim için yardımcı oldu saaaaaağ olun 🤪
çok teşekkürler sınava çalışmak için örnek çözümler arıyordum çok yardımcı oldu Allah razı olsun 👍👍👍💖
çok yararlı oldu bu bilgiler.
Performans ödevim için lazımdı çok teşekkürler
çok yararlı teşekkürler
örnkler maalesef yok ama konu anlatımı güzel teşşekkür ediyorum ….
ciddi adamm….
Allah razı olsun sizden çok güzel olmuş
Çok işime yaradı teşekkürler