İzotop, İzoton, İzobar Atomlar ve İzoelektronik Tanecikler 9. Sınıf Kimya
İzotop Atomlar
Proton sayısı aynı, nötron sayısı ve nükleon sayısı farklı atomlardır.
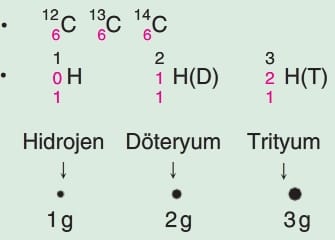
İzotop atomların proton ve elektron sayıları aynı olduğundan kimyasal özellikleri aynıdır. Nötron sayıları farklı olduğundan fiziksel
özellikleri farklıdır.
![]() taneciklerinde ise elektron sayısı farklı olduğundan kimyasal ve fiziksel özellikleri farklıdır.
taneciklerinde ise elektron sayısı farklı olduğundan kimyasal ve fiziksel özellikleri farklıdır.
* Kimyasal özellik: p, e–
Fiziksel özellik: p, e–, n
sayıları ile belirlenir.
* Periyodik tabloya bakıldığında birçok elementin kütle numarasının olduğu bölümde küsuratlı sayılar vardır. Bunun sebebi elemente ait farklı izotopların olmasıdır. Elemente ait izotopların kütle numaralarının ağırlıklı ortalaması alınarak ortalama atom kütleleri hesaplanır.
![]()
OAK: Ortalama atom kütlesi
KN1: 1. izotopun kütle numarası
%1: 1. İzotopun kütlece yüzdesi
K.N2: 2. izotopun kütle numarası
%2: 2. izotopun kütlece yüzdesi
İzoton Atomlar
Nötron sayısı aynı, proton ve nükleon sayısı farklı atomlardır.

İzoton atomların proton ve elektron sayıları farklı olduğundan kimyasal ve fiziksel özellikleri de farklıdır.
İzobar Atomlar
Nükleon sayıları aynı, proton ve nötron sayıları farklı atomlardır.

* İzoton atomların proton, nötron ve elektron sayıları farklı olduğundan kimyasal ve fiziksel özellikleri de farklıdır.
İzoelektronik Tanecikler
Elektron sayısı ve dizilişi aynı, atom numaraları farklı taneciklerdir.
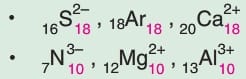
İzoelektronik taneciklerin proton sayıları farklı olduğu için kimyasal ve fiziksel özellikleri de farklıdır.
Örnek
Aşağıdaki grafikte A, B ve C element atomlarının nötron sayısı – proton sayısı bilgileri verilmiştir.
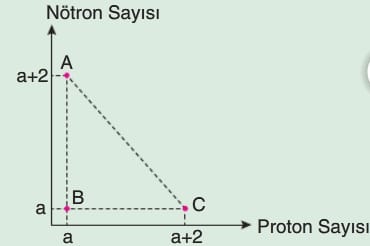
Buna göre, grafiğe bakılarak şu yorumlar yapılabilir.
* A ve B izotoptur.
* B ve C izotondur.
* A ve C izobardır.
* B ve C2+ izoelektroniktir.
İzotop, İzoton, İzobar Atomlar ve İzoelektronik Tanecikler Video
Çözümlü Örnek Test Soruları
Konu: İzotop, İzoton, İzobar Atomlar ve İzoelektronik Tanecikler
Soru 1:
Proton sayısı 17, nötron sayısı 18 olan bir atom ile proton sayısı 17, nötron sayısı 20 olan bir atom aşağıdaki kavramlardan hangisi ile tanımlanır?
A) İzotop
B) İzoton
C) İzobar
D) İzoelektronik
Çözüm:
Proton sayıları aynı olan atomlar izotop atomlardır. Bu durumda her iki atomun da proton sayısı 17 olduğundan izotop atomlardır.
Cevap: A
Soru 2:
Proton sayısı 15, nötron sayısı 16 olan bir atom ile proton sayısı 14, nötron sayısı 16 olan bir atom aşağıdaki kavramlardan hangisi ile tanımlanır?
A) İzotop
B) İzoton
C) İzobar
D) İzoelektronik
Çözüm:
Nötron sayıları aynı olan atomlar izoton atomlardır. Her iki atomun nötron sayısı 16 olduğundan izoton atomlardır.
Cevap: B
Soru 3:
Proton sayısı 20, nötron sayısı 20 olan bir atom ile proton sayısı 18, nötron sayısı 22 olan bir atom aşağıdaki kavramlardan hangisi ile tanımlanır?
A) İzotop
B) İzoton
C) İzobar
D) İzoelektronik
Çözüm:
Kütle numaraları aynı olan atomlar izobar atomlardır. Birinci atomun kütle numarası 20 + 20 = 40, ikinci atomun kütle numarası 18 + 22 = 40 olduğundan izobar atomlardır.
Cevap: C
Soru 4:
Elektron sayısı 10 olan bir atom ile neon (Ne) atomu aşağıdaki kavramlardan hangisi ile tanımlanır?
A) İzotop
B) İzoton
C) İzobar
D) İzoelektronik
Çözüm:
Elektron sayıları aynı olan atomlar izoelektronik taneciklerdir. Verilen atom ile neon atomunun elektron sayısı 10 olduğundan izoelektronik taneciklerdir.
Cevap: D
Soru 5:
Proton sayısı 19, nötron sayısı 20 olan bir atom ile proton sayısı 18, nötron sayısı 21 olan bir atom hangi kavramlarla ilişkilendirilebilir?
A) İzotop ve izoelektronik
B) İzoton ve izobar
C) İzotop ve izoton
D) İzobar ve izoelektronik
Çözüm:
Birinci atomun nötron sayısı 20, ikinci atomun nötron sayısı 21 olduğundan nötron sayıları farklıdır ve izoton değillerdir. Ancak kütle numaraları 39 olduğundan izobar atomlardır. Elektron sayıları aynı olmadığından izoelektronik değildir.
Cevap: B
Çok kaliteli…
Faydalı bilgiler var ama keşke konu anlatımı da olsaydii
sınavda bittim ben
anlatımı gayet beğendim. emeği geçenlerin emeğine sağlık.
güzel olmuş beğendim açıkçası
anlatım çok iyi
hoca iyi anlatmış
teşekkürler eokultv
Yok matematik daha gzl 😂
Kimya çok güzel bir ders
guzel
ben çok beğendim güzeldi yani erkekler yokmu
ben çok beğendim