Isı, Sıcaklık ve İç Enerji Tyt Fizik
Isı, Sıcaklık ve İç Enerji
Sıcaklık ve sıcaklık Ölçümü
Sıcaklık, bir maddenin rastgele hareket eden moleküllerinin ortalama kinetik enerjileri ile doğru orantılı olarak değişen bir niceliktir. Madde moleküllerinin ortalama kinetik enerjisi artarsa maddenin sıcaklığı yükselir, azalırsa maddenin sıcaklığı düşer.
SI birim sisteminde sıcaklığın sembolü T, birimi kelvin (K) dir. Sıcaklık, SI birim sistemindeki temel büyüklüklerden biridir ve skaler bir büyüklüktür. Sıcaklık termometre ile ölçülür. Fırın gibi ortamlardaki yüksek sıcaklıklar katı termometreler, oda sıcaklığı gibi orta düzeydeki sıcaklıkları ölçmek için sıvılı termometreler, çok düşük sıcaklıkları ölçmek için ise gazlı termometreler tercih edilir.
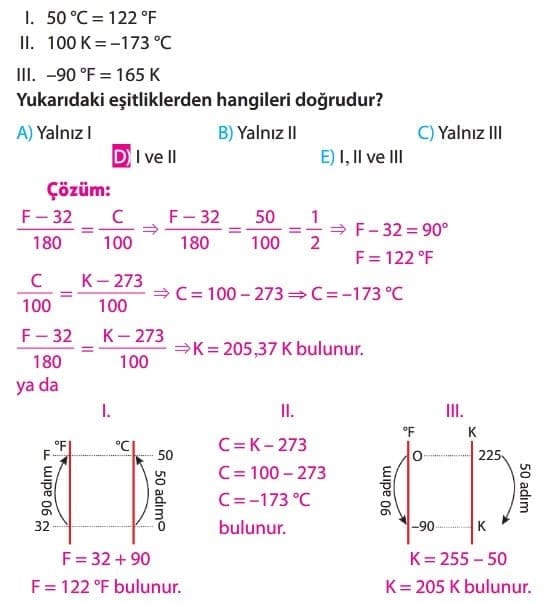
Sıcaklık Birimleri


Maddeyi oluşturan tüm moleküllerin hareketinin durduğu ve daha ötesi bir soğumanın olamayacağı kabul edilen sıcaklığa mutlak sıfır noktası denir.
Kelvin termometresi oran ölçeği ile yapılmıştır. Oran ölçeğinde sıfır yokluğu ifade eder. Bu nedenle oran ölçeğinde negatif değerler olmaz. 0 K’de madde molekülleri hareketsiz kabul edilir. Aralık ölçeği ile tasarlanan Celsius ve Fahrenheit termometrelerinde 0 oC ve 0 oF noktaları keyfi seçilmiştir. Fahrenheit ve Celcius termometrelerinde negatif değerler vardır.
0 K = —273 oC = —459 oF olduğundan Fahrenheit termometresinde —459 oF sıcaklığın altında, Celsius termometresinde de —273 oC sıcaklığın altında bir sıcaklık ölçülemez. Ayrıca oran ölçeklerinde ölçüm sonuçlarının oranlanması anlamlı, aralık ölçeklerindeki ölçüm sonuçlarının oranlanması anlamlı değildir. Örneğin oran ölçeği ile ölçülen uzunluk, kütle, hacim gibi çokluk belirten büyüklükler için “30 cm uzunluk, 10 cm uzunluğun 3 katıdır.”,“20 K sıcaklık 5 K sıcaklığın 4 katıdır.” gibi ifadeler anlamlıdır ancak aralık ölçeği ile ölçülen niceliklerde böyle bir oran olmadığından “20 oF sıcaklık 10 oF sıcaklığın 2 katıdır.” ifadeleri doğru değildir.
Isı ve İç Enerji
Sıcaklıkları farklı iki sistem arasında, sıcaklığı yüksek olan sistemden sıcaklığı düşük olan sisteme aktarılan enerjiye ısı denir.
SI birim sisteminde ısının sembolü Q, birimi joule (J) dür. Isı birimi olarak kalori birimi de kullanılır. (1 cal =4,16 J) 1 kalori; 1 gram saf suyun sıcaklığını 1 oC yükseltmek için gerekli olan enerjidir. Isı SI birim sistemindeki türetilmiş ve skaler büyüklüklerdendir. Kalorimetre kabı ile ölçülür.
Bir sistemi oluşturan atom ve moleküllerin kinetik ve potansiyel enerjilerinin toplamına iç enerji denir. İç enerjinin SI birim sisteminde sembolü C, birimi Joule ve birim sembolü J dür.
Isı Sığası
Bir cismin sıcaklığını 1 oC yükseltmek için cisme verilmesi gereken ısı miktarına o cismin ısı sığası denir. Isı sığasının SI birim sisteminde sembolü C ve birimi Joule/Kelvin (J/K)’dir. Isı sığası, SI’daki türetilmiş ve skaler büyüklüklerdendir.

Öz Isı
Bir cismin kütlesi başına düşen ısı sığasına o cismin öz ısısı denir. SI birim sisteminde öz ısının sembolü c ve birimi
Joule/kelvin.kilogram ve birim sembolü J/K.kg dır. Öz ısı, SI sistemindeki türetilmiş ve skaler bir büyüklüktür. Öz ısı, bir cisme verilen ısıya karşı cismin ısıl duyarlılığının bir ölçüsüdür. Bu nedenle öz ısı, maddeler için ayırt edici bir özeliktir. Isı sığası C olan bir cismin kütlesi m ise öz ısısı ![]() ifadesi ile hesaplanır.
ifadesi ile hesaplanır. ![]() olduğuna göre kütlesi m olan bir maddenin sıcaklığı ΔT kadar değiştiğinde madde ile çevresi arasında aktarılan enerji yani ısı Q ise
olduğuna göre kütlesi m olan bir maddenin sıcaklığı ΔT kadar değiştiğinde madde ile çevresi arasında aktarılan enerji yani ısı Q ise ![]() formülü ile hesaplanır.
formülü ile hesaplanır.
Buna göre öz ısıyı; 1 gram maddenin sıcaklığını 1oC yükseltmek için maddeye vermemiz gereken kalori cinsinden ısı miktarı olarak tanımlayabiliriz. Örneğin 1 gram suyun sıcaklığını 1oC yükseltmek için 1 cal ısı gerekir. Suyun öz ısısı csu : 1 cal/g.oC tur.
Günlük yaşantımızda karşılaştığımız maddeler arasında öz ısısı en büyük olan madde sudur. Öz ısısı büyük olan maddeler öz ısısı küçük olan maddelere göre daha geç ısınıp daha geç soğur. Örneğin suyun öz ısısı kara parçalarının öz ısısından daha büyük olduğu için denizler karalara göre daha geç ısınır ve daha geç soğur. Isıtma ve soğutma sistemlerinde su kullanılmasının sebebi de suyun öz ısısının diğer maddelerden daha büyük olmasıdır.