Isı – Sıcaklık – Genleşme Fizik Tyt
Sıcaklık
Bir maddenin moleküllerinin ortalama kinetik enerjisinin bir ölçüsüdür. Termometreyle ölçülür. Birimleri ºK, ºC, ºF’dir.
Termometre
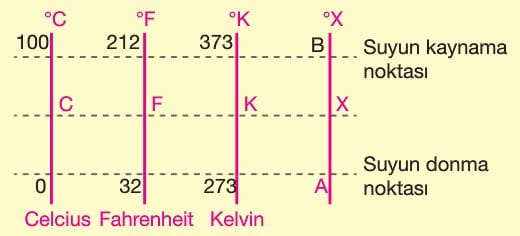
Termometre genellikle maddelerin sıcaklık karşısında genleşmesinden yararlanılarak yapılır. Termometreler tasarlanırken suyun donma ve kaynama noktaları temel değerler olarak alınmıştır.
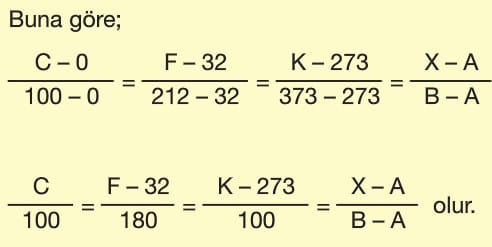
Aynı ortamdaki farklı termometrelerde farklı değerler okunur. Bu değerler arasındaki ilişki birbirine karşılık gelen aralıkların oranlarıyla bulunur.
Kelvin termometresi bilimsel çalışmalarda kullanılır. 0ºK = – 273 ºC sıcaklığı mutlak sıfır noktası kabul edilir. Bu sıcaklıktan daha düşük sıcaklıklar ölçülemez.
İç Enerji
Bir cismin moleküllerinin sahip olduğu potansiyel enerji ve kinetik enerjilerin toplamına iç enerji denir.
Isı
Sıcaklık farkından dolayı maddeler arasında transfer edilen enerjiye ısı denir. Kalorimetre kabıyla ölçülür. Birimleri Joule veya kaloridir.
Sıcaklık Değişimi
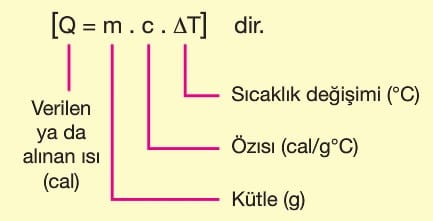
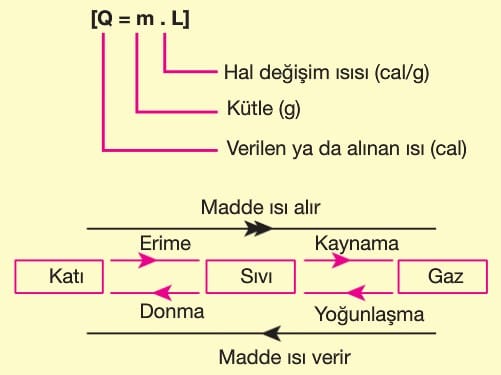
Bir maddeye ısı verilirse sıcaklığı artar, maddeden ısı alınırsa sıcaklığı azalır. Maddeye verilen ya da alınan ısı miktarı Q olmak üzere;
Özısı (c): Bir maddenin 1 gramının sıcaklığını 1 ºC değiştirmek için gereken ısı miktarıdır. Maddeler için ayırt edici bir özelliktir.
Isı sığası (m.c): Maddenin kütlesi ile özısısının çarpımına ısı sığası (ısı kapasitesi) denir. Ayırt edici özellik değildir.
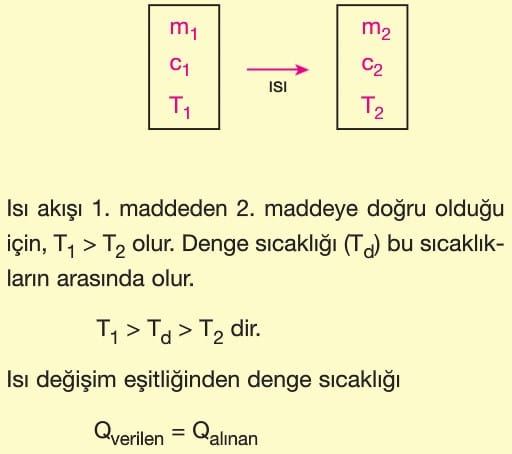
Isı Alışverişi
Isıca yalıtılmış bir ortamda sıcaklıkları farklı maddeler bir araya getirilirse ısı alışverişi olur. Isı akışı sıcak maddeden soğuk maddeye doğru olur. Maddelerin son sıcaklıkları eşit oluncaya kadar (ısıl denge sağlanıncaya kadar) ısı akışı sürer. Sıcak maddenin verdiği ısı soğuk maddenin aldığı ısıya daima eşit olur.
Hal Değişimi
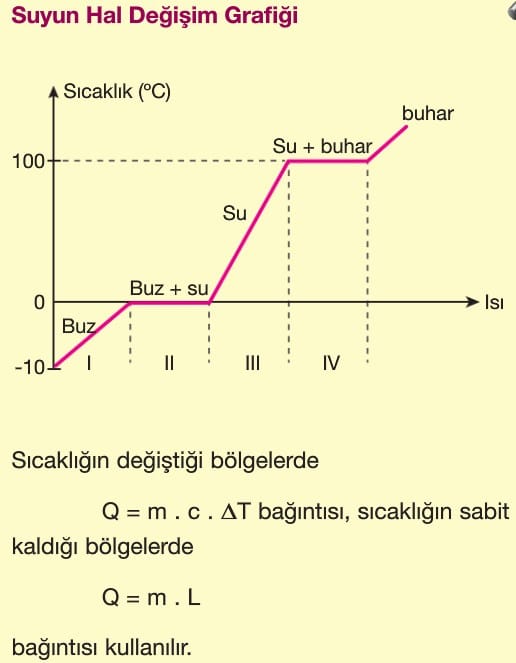
Katı haldeki bir madde ısıtılınca maddeyi oluşturan moleküllerin titreşimi artar ve daha hızlı hareket eder. Bu durumda sıcaklığı artar. Maddeye ısı verilmeye devam edilirse moleküller arasındaki bağlar gevşer ve madde sıvı hale geçer. Benzer şekilde sıvı molekülleri ısıtılınca moleküllerinin hızı artar. Bir süre sonra moleküller arası bağ kopar ve moleküller serbest hale geçer. Yani gaz haline gelir.
Maddenin katı — sıvı — gaz halleri arasındaki bu geçişlere hal değişimi denir. Hal değişimi sırasında maddenin sıcaklığı değişmez. Verilen ısı moleküller arasındaki bağı koparmaya harcanır. Hal değişimi için gerekli ısıya hal değişim ısısı (L) denir.
Bir maddenin erime noktası ile donma noktası, kaynama noktası ile yoğunlaşma noktası aynı değerdedir. Madde erime noktasının altında katı, erime noktası ile kaynama noktası arasında sıvı, kaynama noktasının üstünde gaz haldedir.
Suyun erime ve kaynama noktalarına etki eden faktörler
Basınç:
Basınç artarsa suyun donma noktası düşer, kaynama noktası yükselir.
Saflık:
Su içine tuz karıştırılırsa donma noktası düşer, kaynama noktası yükselir.
Genleşme
Isı alan bir maddenin molekülleri arasındaki mesafe artar. Yani hacminde artma meydana gelir. Eğer madde soğutulursa hacminde azalma meydana gelir. Genleşmeyi katı, sıvı ve gazlarda olmak üzere üç başlıkta inceleyeceğiz.
Katılarda Genleşme:
Katı haldeki bir madde ısıtılırsa hacminde artma meydana gelir. Maddenin boyundaki, yüzeyindeki ya da hacmindeki artma hesaplanabilir.