Isı, Öz Isı, Isı Sığası Ve Sıcaklık Farkı Arasındaki İlişki 9. Sınıf Fizik
Isı, öz ısı, ısı sığası ve sıcaklık farkı, ısıl enerji transferi ve maddenin ısıl davranışlarını açıklamak için kullanılan temel kavramlardır. 9. sınıf fizik müfredatında bu kavramlar arasındaki ilişki, maddelerin ısı alışverişi ve sıcaklık değişimleri sırasında nasıl davranacağını anlamak açısından önemlidir.
Öz Isı
Bir maddenin 1 gramının sıcaklığını 1 °C değiştirmek için maddeye verilmesi ya da maddeden alınması gereken ısı miktarına öz ısı denir. c ile gösterilir.
- Birimi J/kg.°C’dir. Daha çok cal/g.°C kullanılır.
- Maddeler için ayırt edici bir özelliktir.
- Madde miktarına bağlı değildir.
- Suyun öz ısısı 1 cal/g.°C’dir. Bu, 1 gram suyun sıcaklığını 1 °C artırmak için suya 1 cal ısı verilmesi gerektiği anlamına gelir. Buzun öz ısısı 0,5 cal/g.°C’dir. 1 gram buzu 1 °C artırmak için buza 0,5 cal ısı verilmelidir.
- Bu durumda eşit kütleli iki maddeden öz ısısı küçük olanın sıcaklığını değiştirmek için, öz ısısı büyük olanın sıcaklığını değiştirmekten daha az enerji gerektirir.
- Özdeş ısıtıcılarda öz ısısı yüksek olan maddelerin sıcaklık değişimi yavaş, düşük olanlarınki daha hızlı gerçekleşir. Suyun öz ısısı 4,187 J/kg.°C, kumun öz ısısı 1,5 kJ/kg.°C’dir. 1 kg suyun sıcaklığını 1 °C artırmak için 4,187 kJ ısı gerekirken, 1 kg kumun sıcaklığını değiştirmek için 1,5 kJ ısı gerekir.
- Bu nedenle denizler karalardan daha geç ısınır ve daha geç soğur.
Isı Sığası
Bir maddenin sıcaklığını 1 °C değiştirmek için maddeye verilmesi ya da maddeden alınması gereken ısı miktarına ısı sığası denir. C ile gösterilir.
Isı sığası,
C=m . c
eşitliğinden bulunur. (C:ısı sığası m:kütle c:öz ısı)
- Birimi J/°C’dir. Daha çok cal/°C kullanılır.
- Madde miktarına bağlı olduğundan ayırt edici bir özellik değildir.
- Kütlesi ve öz ısısı büyük olan maddelerin sıcaklıklarını değiştirmek için maddeye daha fazla ısı verilmelidir ya da maddeden daha fazla ısı alınmalıdır.
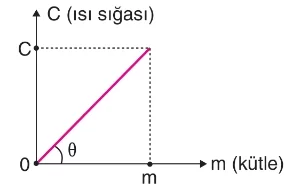
- Isı sığası ile madde miktarı doğru orantılıdır ve grafiği şekil üzerindedir. Doğrunun eğimi maddenin öz ısısını verir.
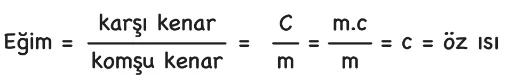
Isı, Öz Isı, Isı Sığası ve Sıcaklık Farkı İlişkisi – Çözümlü Örnek Sorular
Isı Alışverişi Formülü:
Isı, öz ısı, ısı sığası ve sıcaklık farkı arasındaki ilişkiyi belirten temel formül şu şekildedir:
Q = m * c * ΔT
Burada:
- Q: Alınan ya da verilen ısı miktarı (Joule – J)
- m: Maddenin kütlesi (kg ya da g)
- c: Maddenin öz ısısı (J/kg°C)
- ΔT: Sıcaklık farkı (Tson – Tbaşlangıç)
Örnek 1:
Soru: 400 gram suyun sıcaklığını 20°C’den 80°C’ye çıkarmak için ne kadar ısı gerekir? Suyun öz ısısı 4.18 J/g°C’dir.
Çözüm:
- Kütle (m): 400 g
- Sıcaklık farkı (ΔT): 80°C – 20°C = 60°C
- Öz ısı (c): 4.18 J/g°C
Isı miktarı formülü:
Q = m * c * ΔT
Q = 400 g * 4.18 J/g°C * 60°C
Q = 10032 J
400 gram suyun sıcaklığını 20°C’den 80°C’ye çıkarmak için 10032 joule ısı gerekmektedir.
Örnek 2:
Soru: 300 gram demirin sıcaklığını 25°C’den 100°C’ye çıkarmak için ne kadar ısı gerekir? Demirin öz ısısı 0.450 J/g°C’dir.
Çözüm:
- Kütle (m): 300 g
- Sıcaklık farkı (ΔT): 100°C – 25°C = 75°C
- Öz ısı (c): 0.450 J/g°C
Isı miktarı formülü:
Q = m * c * ΔT
Q = 300 g * 0.450 J/g°C * 75°C
Q = 10125 J
300 gram demirin sıcaklığını 25°C’den 100°C’ye çıkarmak için 10125 joule ısı gerekmektedir.
Örnek 3:
Soru: 500 gram bakırın sıcaklığını 30°C’den 90°C’ye çıkarmak için ne kadar ısı gerekir? Bakırın öz ısısı 0.385 J/g°C’dir.
Çözüm:
- Kütle (m): 500 g
- Sıcaklık farkı (ΔT): 90°C – 30°C = 60°C
- Öz ısı (c): 0.385 J/g°C
Isı miktarı formülü:
Q = m * c * ΔT
Q = 500 g * 0.385 J/g°C * 60°C
Q = 11550 J
500 gram bakırın sıcaklığını 30°C’den 90°C’ye çıkarmak için 11550 joule ısı gerekmektedir.
Örnek 4:
Soru: 1.5 kg suyun sıcaklığını 10°C’den 50°C’ye çıkarmak için ne kadar ısı gerekir? Suyun öz ısısı 4.18 J/g°C’dir.
Çözüm:
- Kütle (m): 1.5 kg = 1500 g
- Sıcaklık farkı (ΔT): 50°C – 10°C = 40°C
- Öz ısı (c): 4.18 J/g°C
Isı miktarı formülü:
Q = m * c * ΔT
Q = 1500 g * 4.18 J/g°C * 40°C
Q = 250800 J
1.5 kg suyun sıcaklığını 10°C’den 50°C’ye çıkarmak için 250800 joule ısı gerekmektedir.
Örnek 5:
Soru: 200 gram alüminyumun sıcaklığını 50°C’den 150°C’ye çıkarmak için ne kadar ısı gerekir? Alüminyumun öz ısısı 0.900 J/g°C’dir.
Çözüm:
- Kütle (m): 200 g
- Sıcaklık farkı (ΔT): 150°C – 50°C = 100°C
- Öz ısı (c): 0.900 J/g°C
Isı miktarı formülü:
Q = m * c * ΔT
Q = 200 g * 0.900 J/g°C * 100°C
Q = 18000 J
200 gram alüminyumun sıcaklığını 50°C’den 150°C’ye çıkarmak için 18000 joule ısı gerekmektedir.
Özet:
Isı Nedir?
Isı, sıcaklık farkından dolayı bir maddeden diğerine aktarılan enerjidir. Isı, yüksek sıcaklıktaki maddeden düşük sıcaklıktaki maddeye doğru akar. Isı enerjisi birimi joule (J) veya kaloridir.
Öz Isı Nedir?
Öz ısı, bir maddenin 1 gramının sıcaklığını 1°C artırmak için gerekli olan ısı miktarıdır. Öz ısı, “c” harfi ile gösterilir ve birimi J/(g°C) ya da J/(kg°C) olarak ifade edilir.
- Öz Isı (c): 1 gram ya da 1 kilogram madde için sıcaklığı 1°C değiştirmek için gerekli olan ısı enerjisi.
Isı Sığası Nedir?
Isı sığası, bir maddenin sıcaklığını belirli bir miktarda artırmak için gereken toplam ısı miktarıdır. Isı sığası, cismin kütlesine ve öz ısısına bağlıdır. Bir maddenin ısı sığası şu formülle hesaplanır:
C = m × c
- C: Isı sığası (J/°C)
- m: Kütle (kg)
- c: Öz ısı (J/kg°C)
Isı ile Sıcaklık Arasındaki İlişki
Isı, bir cisme verildiğinde o cismin sıcaklığı artar. Ancak bu sıcaklık artışı, cismin kütlesine, öz ısısına ve verilen ısı miktarına bağlıdır. Isı ile sıcaklık değişimi arasındaki ilişki şu formülle ifade edilir:
Q = m × c × ΔT
- Q: Aktarılan ısı miktarı (Joule)
- m: Cismin kütlesi (kg)
- c: Maddenin öz ısısı (J/kg°C)
- ΔT: Sıcaklık farkı (°C)
Bu formüle göre, ısı miktarı (Q), kütle, öz ısı ve sıcaklık farkına bağlıdır. Sıcaklık farkı ne kadar büyükse, cisme verilen veya alınan ısı da o kadar fazla olur.
Öz Isı, Isı Sığası ve Sıcaklık Farkı Arasındaki İlişki
- Öz Isı ve Sıcaklık Farkı: Bir maddenin öz ısısı büyükse, bu maddeyi ısıtmak için daha fazla enerji gerekir. Öz ısısı düşük olan maddeler daha hızlı ısınır ve soğur. Örneğin, suyun öz ısısı yüksektir, bu yüzden yavaş ısınır ve yavaş soğur.
- Isı Sığası ve Sıcaklık Farkı: Bir cismin ısı sığası, o cismin toplam kütlesi ve öz ısısına bağlıdır. Büyük bir kütleye sahip maddeler, daha fazla ısı enerjisi depolar ve sıcaklık değişimi daha yavaş olur.
Örnekler
- Su ve Metal: Su ve metal aynı miktarda ısıtıldığında, suyun öz ısısı daha yüksek olduğu için sıcaklığı daha yavaş artar. Metal ise düşük öz ısısı nedeniyle daha hızlı ısınır.
- Termos: Termos içindeki sıvı, yüksek öz ısıya sahip olduğu için uzun süre sıcak kalır. Bu, termosun içindeki sıvının ısıl enerjiyi daha uzun süre tutabilmesiyle ilgilidir.
- Toprak ve Hava: Gündüz vakti, toprak havaya göre daha çabuk ısınır. Çünkü toprağın öz ısısı havaya göre daha düşüktür. Aynı şekilde, gece olduğunda toprak havadan daha hızlı soğur.