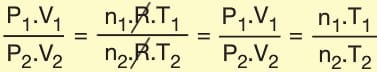İdeal Gaz Yasası ve Gazlarda Kinetik Teori Kimya Ayt
İDEAL GAZ YASASI – KİNETİK TEORİ
İdeal Gaz Denklemi
Gaz yasalarını açıklarken kullanılan eşitlikler bir araya getirildiğinde ideal gaz denklemi elde edilir.
Basınç ve hacim ters orantılı, n ve T ise P ve V ile doğru orantılıdır.
İdeal gaz;
1. Molekülleri arası çekme ve itme kuvvetlerinin
2. Gaz taneciklerinin öz hacimlerinin ihmal edildiği gazlardır. İdeal gazlar ![]() denkliğini sağlarlar.
denkliğini sağlarlar.
Gerçekte %100 ideal gaz olarak davranan gaz yoktur. Ancak gerçek gazlar özellikle düşük basınç ve yüksek sıcaklıklarda ideale yakın davranırlar.
Gaz sabitinin değerini P, V, n ve T ile ilgili deneysel verilerden hesaplayabiliriz.
Birleştirilmiş Gaz Denklemi
Gazlarla ilgili iki ya da daha fazla değişkenin (P, V, T veya n) değiştiği durumlarda gaz yasaları yeterli olmaz. Bunun yerine, gazın iki farklı durumu için ideal gaz denklemleri yazılıp oranlanır.
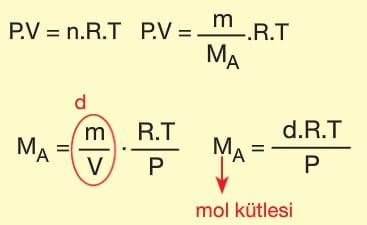
İdeal Gaz Denkleminden Mol Kütlesi Hesaplama
İdeal gaz denkleminden mol kütlesi hesaplamada kullanılan yöntemlerden biri Victor Meyer yöntemidir. Yöntemin teorik kısmı ideal gaz denkleminin aşağıdaki şekilde yeniden düzenlenmesi ilkesine dayanır.
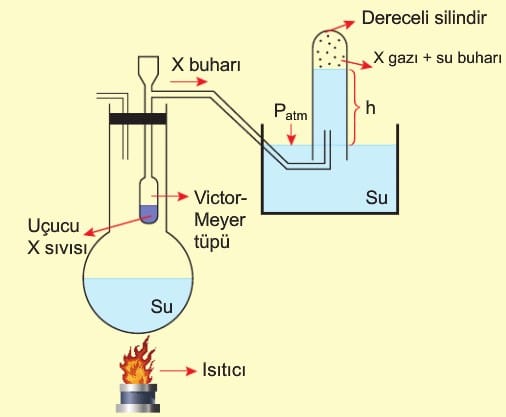
Victor—Meyer yönteminde uçucu sıvıların mol kütleleri deneysel olarak bulunur. Şekildeki Viktor-Meyer tüpüne kütlesi bilinen uçucu X sıvısı konularak altında kaynayan suyla tamamen buharlaştırılır. Buharlaşan X sıvısının buharı su dolu kaba ters daldırılmış içi su dolu dereceli silindire gönderilir. X buharı yaptığı basınçla suyu aşağıya doğru iter. X sıvısı tamamen buharlaşınca silindirdeki su seviyesi sabitlenir. Dereceli silindirden X buharının hacmi belirlenir.
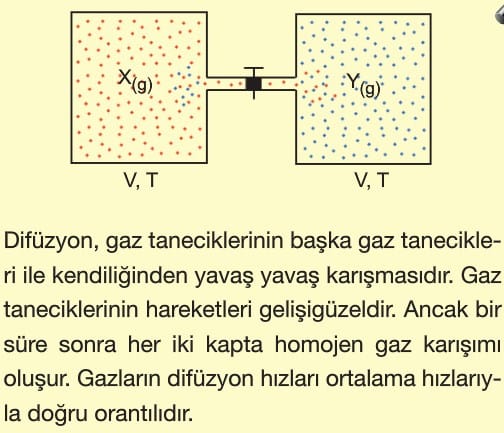
Gazların Kinetik Teorileri
Gazların kinetik teorisi, gazların davranışlarını moleküler düzeyde açıklamak için yapılan genellemeler ve varsayımlardan oluşur.
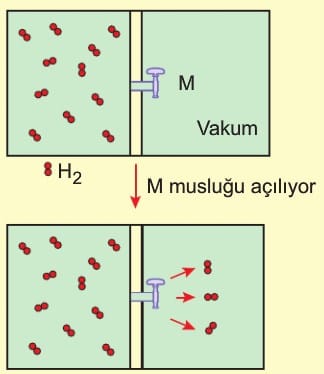
1 . Gazlar sürekli olarak gelişigüzel ancak doğrusal hareket ederler. (Brown Hareketi)
2. Gaz tanecikleri arası büyük boşluklar bulunur. Gazın kapladığı hacmin büyük bir kısmı boşluk olduğundan gaz moleküllerinin kendi hacimleri yok sayılır. Moleküller, kütlesi olan ancak öz hacmi olmayan tanecikler olarak düşünülür.
3. Tanecikler birbiriyle ve bulundukları kabın iç çeperleriyle hızlı bir şekilde çarpışırlar.
4. Gaz molekülleri arasında hiçbir çekme ve itme kuvveti olmadığı kabul edilir.
5. Sabit sıcaklıkta, moleküller birbiriyle çarpışarak enerji kazanabilir veya kaybedebilirler. Ancak, toplam enerji değişmez.
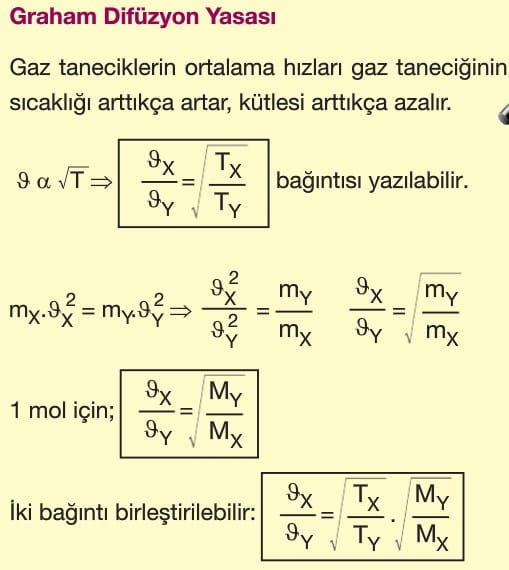
6. Gaz taneciklerinin ortalama kinetik enerjisi gazın mutlak sıcaklığı ile doğru orantılıdır.