İdeal Gaz Yasası 11. sınıf kimya
İdeal gaz yasası bundan önce öğrendiğimiz gaz kanunlarının birleştirilmiş halidir. İdeal gaz yasasına geçmeden önce ileride ayrıntılı öğreneceğimiz ideal gazın ne olduğuna kısaca bakalım.
İDEAL GAZ
Bulunduğu koşullarda birbirini etkilemeyen bir başka ifadeyle bulunduğu sıcaklık ve basınçta sıvılaşmayan gazlar olarak ifade edebiliriz. Gerçekte ideal gaza ulaşmak çok zordur. Bu nedenle biz bir çok işlemde gazları ideal kabul edeceğiz. Daha önce öğrendiğimiz gaz kanunlarını hatırlayalım.
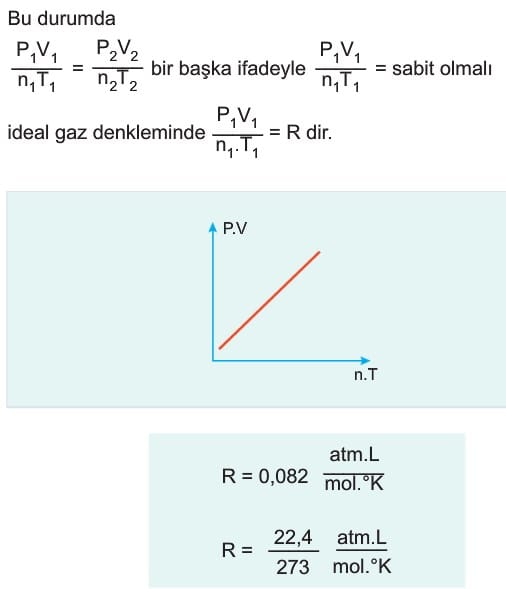
Bu durumda ideal gaz denklemi:
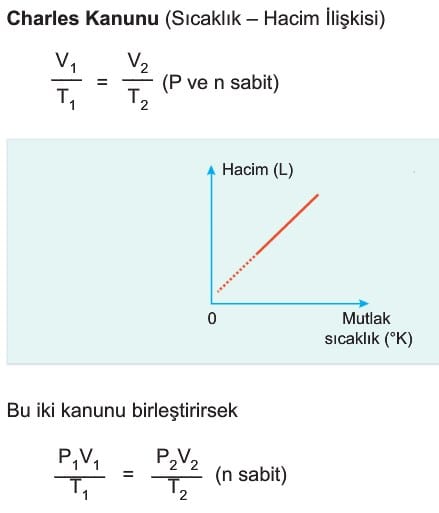
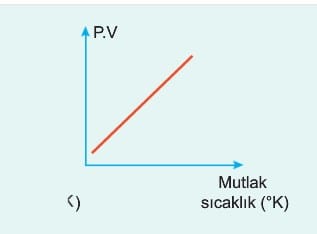
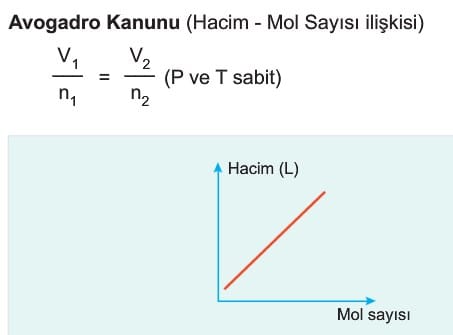
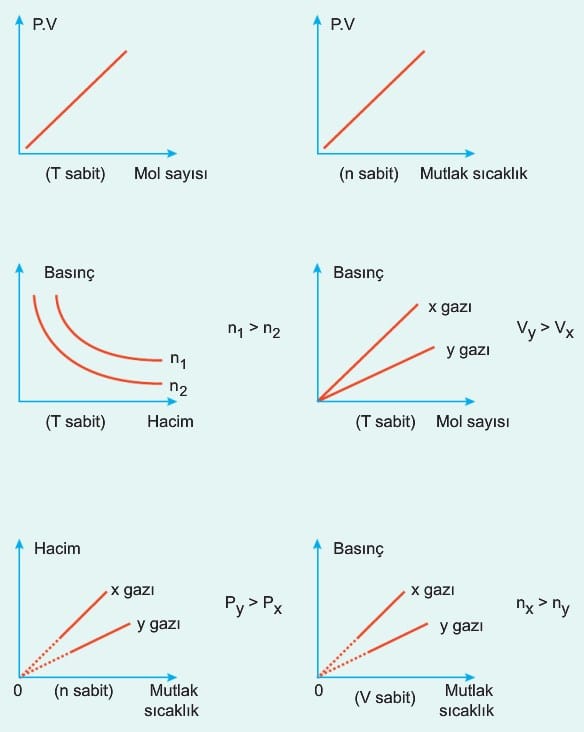
İdeal Gaz Denklemi ile İlgili Grafikler
İdeal gazların değişim grafikleri incelenirken hangi değerlerin sabit kaldığına dikkat edilmelidir.
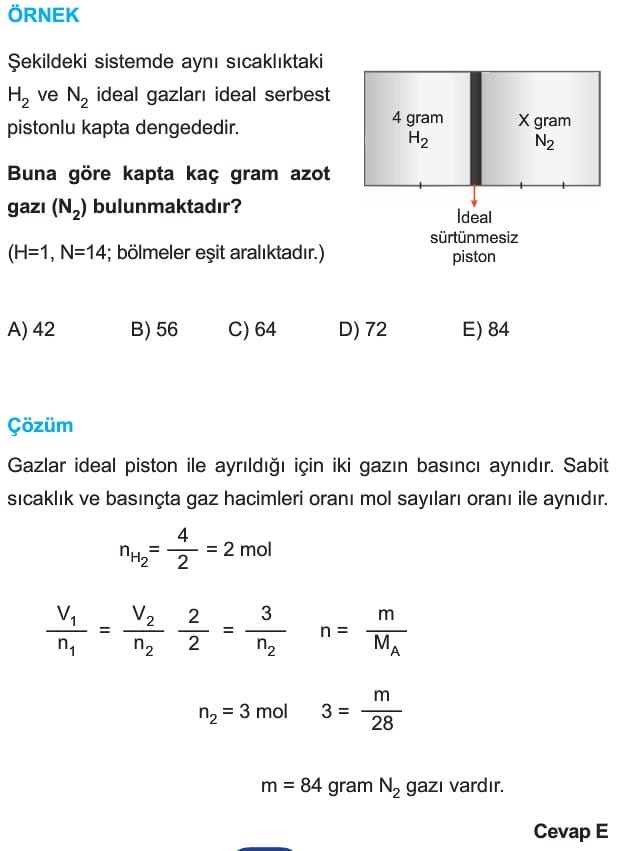
1. İdeal Gaz Denkleminin Kullanımı
Karşılaştığınız sorularda tek durum varsa mesela sıcaklık, basınç ve mol sayısı verilmiş, hacim soruluyor ise,
P.V = n.R.T yazılır. P, V, n, R, T değerleriyle ilgili gerekli birim dönüşümleri yapılarak, bu değerler denklemde yerine yazılır ve istenilen sonuç hesaplanır.
Eğer soruda iki durum varsa yani önce bazı değerler verilmiş ve sonra bu değerlerden en az biri değişmiş ise, iki tane ideal gaz denklemi birbirine bölünerek sonuca gidilir. Bu durumda basınç ve hacmin birimi değiştirilebilir; ancak sıcaklığın birimi mutlaka Kelvin olmalıdır.
- Eğer soruda bir değer değişmemiş ise o değer sadeleştirilir.
- Bir değerden hiç bahsedilmemiş veya sabit basınç, sabit sıcaklık gibi ifadeler kullanılmış ise 0 değerler de sadeleşir.
- Kalanların oranı sonucu verecektir.
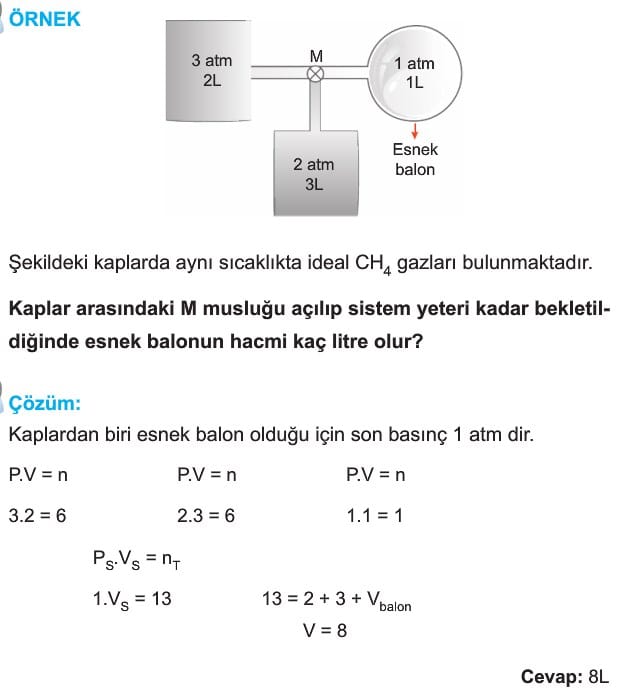
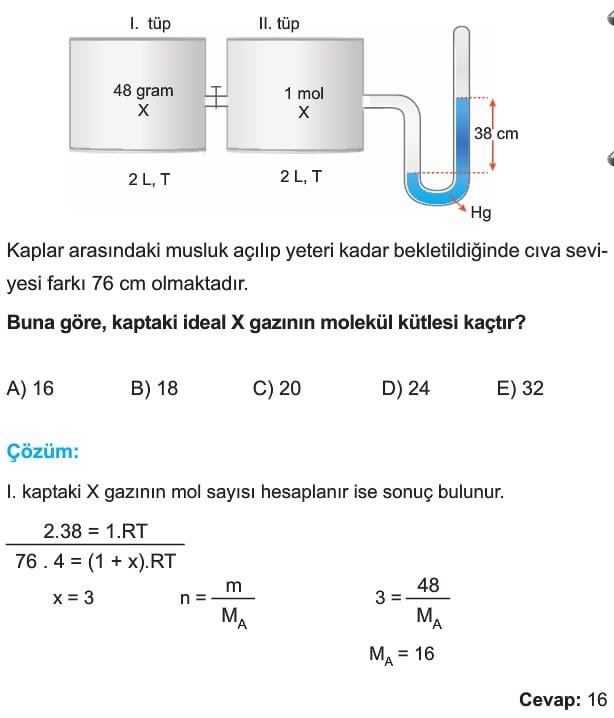
2. Birleştirilmiş Kaplar
Birleştirilmiş kaplar iki farklı kabın bir musluk yardımıyla birbirine bağlanması ile oluşturulan sistemlerdir. Eğer musluk açılır ve yeteri kadar beklenirse gazlar, her iki kapta homojen karışır ve iki kaptaki basınç eşitlenir. Bu durumda da iki ideal gaz denkleminin oranından veya sıcaklıklar aynı ise,
P.V = n
eşitliği ile hesaplama yapılabilir. Bir başka ifadeyle tüm kaplardaki P.V değerleri toplamı Pson . Vson değerine eşitlenir.
P1V1 + P2V2 + … = PsonVson
BİLGİ: Kimyasal tepkimeli gaz sorularında tepkime denkleminde katı veya sıvı halde bulunan madde varsa, bunların basıncı belirtilmediği sürece işleme dahil edilemez.
Çözümlü Örnek Test Soruları
İdeal gaz yasası, gazların basınç, hacim, sıcaklık ve mol sayısı arasındaki ilişkileri tanımlayan bir denklemdir. Bu yasa, gazların ideal koşullarda nasıl davrandığını anlamamızı sağlar ve birçok deneysel durumu açıklamak için kullanılır.
1. 3 mol ideal gaz 300 K sıcaklıkta ve 2 atm basınç altında bir kapta bulunmaktadır. Eğer gazın sıcaklığı 600 K’ya çıkarılır ve basınç 1 atm olarak sabit tutulursa, gazın yeni hacmi ne olur? (R = 0,082 atm·L/mol·K)
A) 123 litre
B) 246 litre
C) 164 litre
D) 82 litre
Çözüm: İdeal gaz denklemi PV = nRT kullanılarak hacim hesaplanır. Sıcaklık ve basınç değişiklikleri göz önüne alınarak V₁/T₁ = V₂/T₂ denklemi ile hacim bulunur. Cevap B.
2. Bir balonun içinde 1 mol ideal gaz bulunmaktadır. Balonun basıncı 1 atm, sıcaklığı 27°C (300 K) ve hacmi 22,4 litredir. Eğer balonun içindeki gaz miktarı 2 katına çıkarılır ve sıcaklık 600 K’ye çıkarılırsa, balonun yeni hacmi yaklaşık kaç litre olur?
A) 22,4 litre
B) 44,8 litre
C) 89,6 litre
D) 112 litre
Çözüm: İdeal gaz yasasına göre, gaz miktarı ve sıcaklık arttığında hacim de doğru orantılı olarak artar. İlk hacim 22,4 litre olduğunda, hacim bu koşullarda 89,6 litreye ulaşır. Cevap C.
3. Sabit sıcaklık ve basınç altında bir gazın mol sayısı artırıldığında, gazın hacmi nasıl değişir ve bu durumu ideal gaz yasası açısından nasıl açıklayabiliriz?
A) Hacim azalır, çünkü mol sayısı ile hacim ters orantılıdır
B) Hacim artar, çünkü mol sayısı ile hacim doğru orantılıdır
C) Hacim sabit kalır, çünkü sıcaklık ve basınç sabittir
D) Hacim artar, çünkü basınç mol sayısıyla doğru orantılıdır
Çözüm: İdeal gaz yasasına göre (PV = nRT), mol sayısı ile hacim doğru orantılıdır. Mol sayısı arttığında hacim de artar. Cevap B.
4. Bir gazın hacmi 10 litre, sıcaklığı 300 K ve basıncı 2 atm’dir. Eğer gazın sıcaklığı 600 K’ye çıkarılırsa ve hacmi sabit tutulursa, gazın basıncı nasıl değişir?
A) 4 atm olur
B) 3 atm olur
C) 6 atm olur
D) 8 atm olur
Çözüm: İdeal gaz yasasına göre, hacim sabitken sıcaklık artarsa, basınç da artar. Sıcaklık iki katına çıktığı için basınç da iki katına çıkar ve 4 atm olur. Cevap A.
5. 1 mol gaz 0°C ve 1 atm basınçta 22,4 litre hacim kaplar. Aynı gazın basıncı iki katına çıkarıldığında ve sıcaklık 0°C’de sabit tutulduğunda, gazın yeni hacmi ne olur?
A) 11,2 litre
B) 22,4 litre
C) 33,6 litre
D) 44,8 litre
Çözüm: Boyle yasasına göre, basınç arttıkça hacim ters orantılı olarak azalır. Basınç iki katına çıkarıldığında hacim yarıya iner, yani yeni hacim 11,2 litre olur. Cevap A.