Hidrokarbonlar: Alkanlar Kimya Ayt
HİDROKARBONLAR (ALKANLAR)
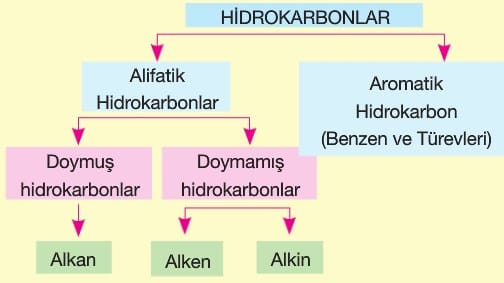
Hidrokarbonlar
Yapısında sadece karbon (C) ve hidrojen (H) içeren bileşiklere denir.
Alifatik Hidrokarbonlar
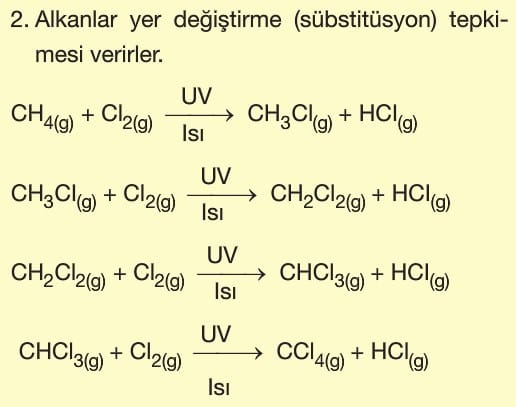
1. Alkanlar (Parafinler)
Yapısında sadece tekli (—) bağ içeren doymuş hidrokarbonlardır.
- Tüm karbonları sp3 hibritleşmesi yapmış olup tüm bağları sigma bağıdır.
- Düz zincirli olanlarının kapalı formülü CnH2n+2 dir.
- Halkalı (siklo) olanlannın kapalı formülü CnH2n dir.
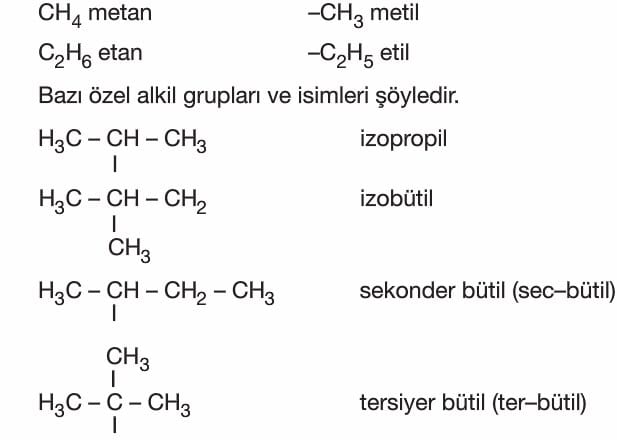
Alkiller
Alkanlardan bir hidrojen çıkarılması sonucu oluşan gruplara alkil adı verilir ve R harfi ile gösterilir.
Alkiller tek başına kararlı yapıda değil radikalik yapıdadır.
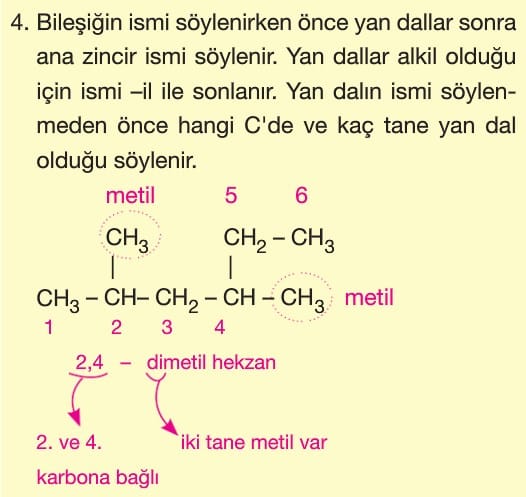
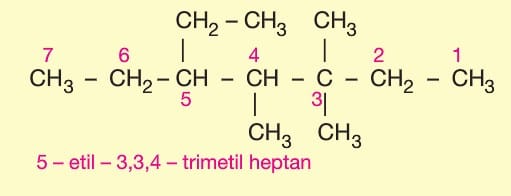
Alkiller türedikleri alkan adının sonundaki —an eki silinip —il eki getirilerek adlandırılırlar.
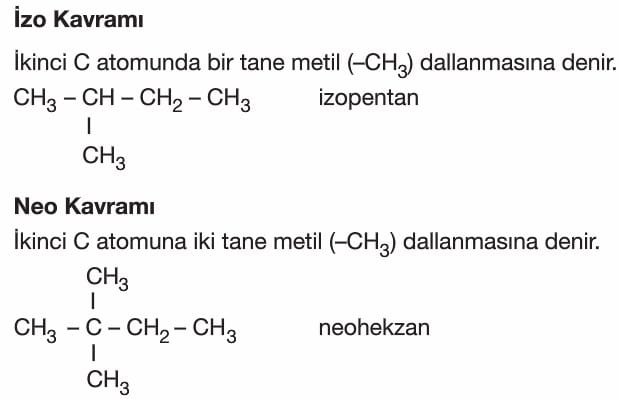
Dikkat: İzo neo adlandırmasında bileşikteki toplam karbon sayısı söylenir.
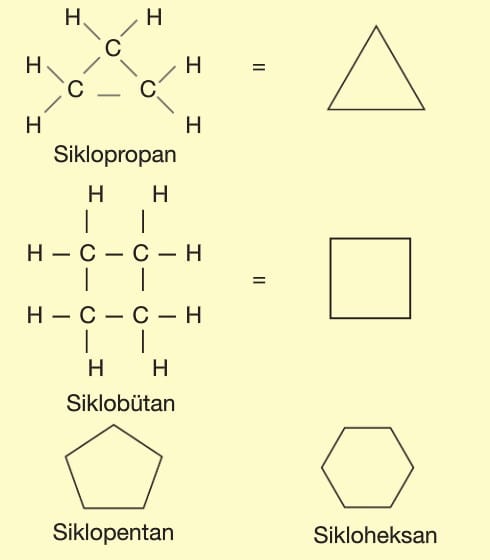
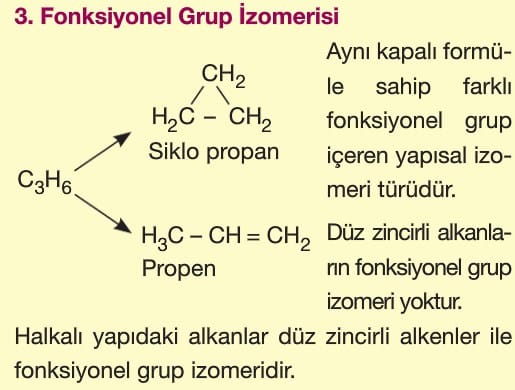
Halkalı (Siklo) Alkanlar
CnH2n genel formülüne uyarlar.
Düz zincirli bir alkanın iki karbon atomundan birer hidrojen atomu kopartılıp karbonların birbiri ile bağlanması sonucu oluşurlar.
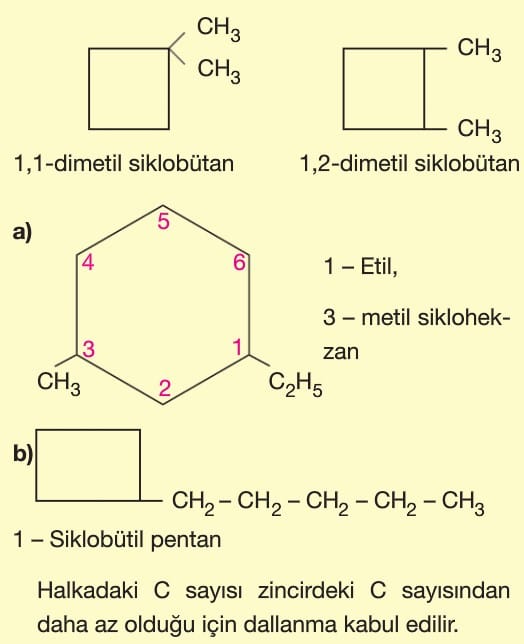
Karbon sayısına karşılık gelen alkanın önüne “siklo” getirilerek adlandırma yapılır.
Halkaya bağlı gruplar en küçük numaraları alacak şekilde adlandırılır.
En küçük üyesi üç karbonludur.
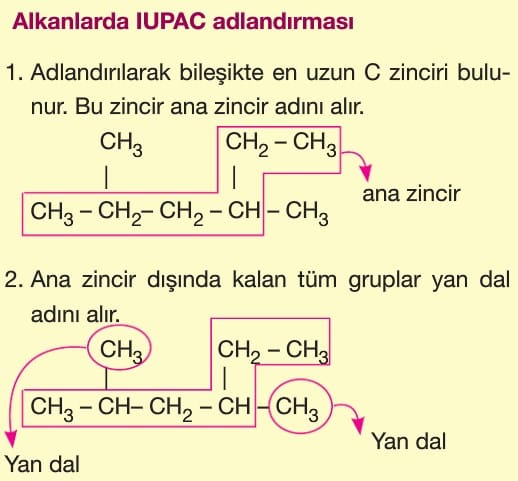
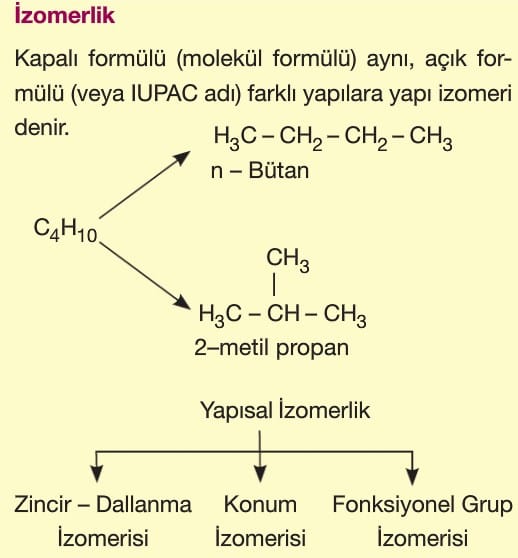
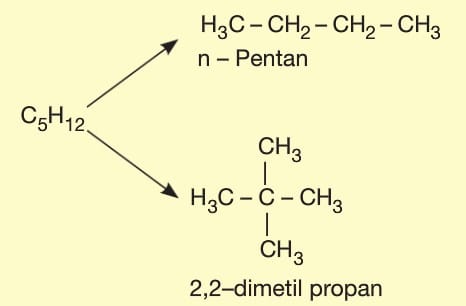
1. Zincir — Dallanma İzomerisi:
Ana zincirdeki karbon sayısı farklı olan yapısal izomerlerdir. Ana zincirdeki karbon sayısı değiştiğinde yan dal sayısı da değiştiği için zincir dallanma izomerisi adını alır.
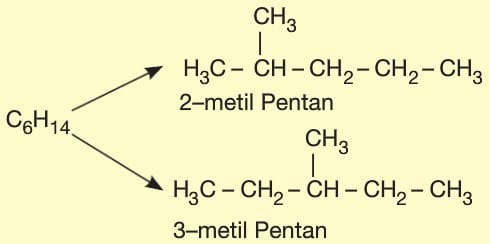
2. Konum İzomerisi
Aynı ana zincirde yan dalın veya fonksiyonel grubun konumunun değişmesi sonucu oluşan yapısal izomeri türüdür.
Alkanların Genel Özellikleri
Başlıca kaynakları petroldür.
Parafinler olarak da adlandırılırlar.
Karbon atomları arasında tekli bağlar bulunur.
Dolayısıyla doymuş hidrokarbonlardır.
Moleküllerindeki her karbon atomu spa hibritleşmesi yapar.
Düz ya da açık zincirli olanların genel formülü CnH2n+2’dir. Halkalı alkanların genel formülü ise CnH2n’dir.
Oda sıcaklığı ve 1 atm basınçta dallanmamış alkanların ilk dört üyesi gaz, beş ve onyedi arası karbona sahip alkanlar sıvı, onsekizden fazla karbona sahip olan alkanlar ise katı halde bulunur.
Apolar yapılı olduklarından molekülleri arasında London kuwetleri bulunur. London kuvvetleri moleküller arası etkileşimlerden en zayıfıdır. Bu nedenle alkanların erime ve kaynama noktaları düşüktür.
Dallanmamış alkanlarda karbon sayısı arttıkça yüzey alanı ve London kuwetleri artar. Bu nedenle karbon sayısı arttıkça kaynama noktaları da yükselir.
Dallanmış alkanlarda ise dallanma miktarı arttıkça yüzey alanı azalacağı için London kuvvetleri ve dolayısıyla da kaynama noktası azalır.
Apolar yapılı olduklarından su gibi polar çözücülerde çözünmezler. En iyi çözündükleri çözücüler; benzen, karbon tetraklcrür, kloroform gibi apolar yapılı çözücülerdir.
Homolog sıra oluştururlar. Homolog sıra moleküllerin birbirinden bir birim kadar farklı olan serilerdir. Alkanlarda bu farklılık —CH2— dır.