Hibritleşme ve Molekül Geometrisi Kimya Ayt
HİBRİTLEŞME VE MOLEKÜL GEOMETRİSİ
Hibritleşme
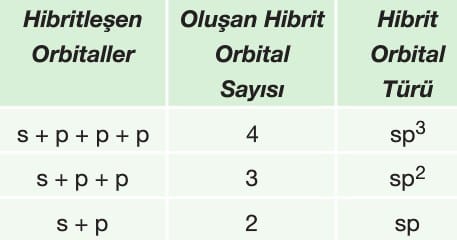
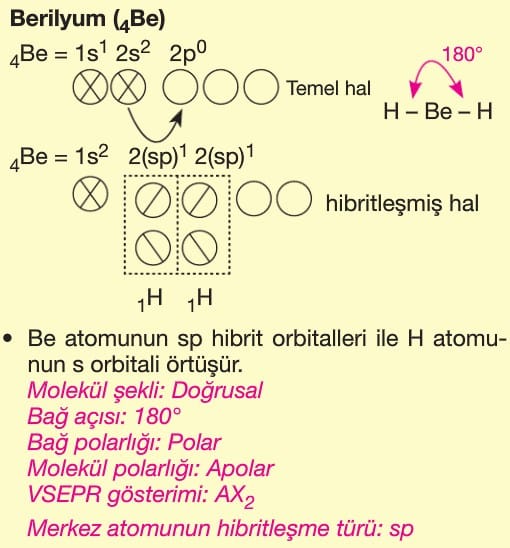
Bir atomun farklı enerjilere sahip orbitallerinin kaynaşarak aynı enerjili özdeş orbitallere dönüşmesine hibritleşme (melezleşme) bu yeni orbitallere de hibrit orbitalleri denir.
Hibrit orbitalleri hibritleşmeye katılan orbitallerin sayısına göre adlandırılır.
Hibritleşmeye katılan orbital sayısı oluşan hibrit orbitalleri sayına eşittir.
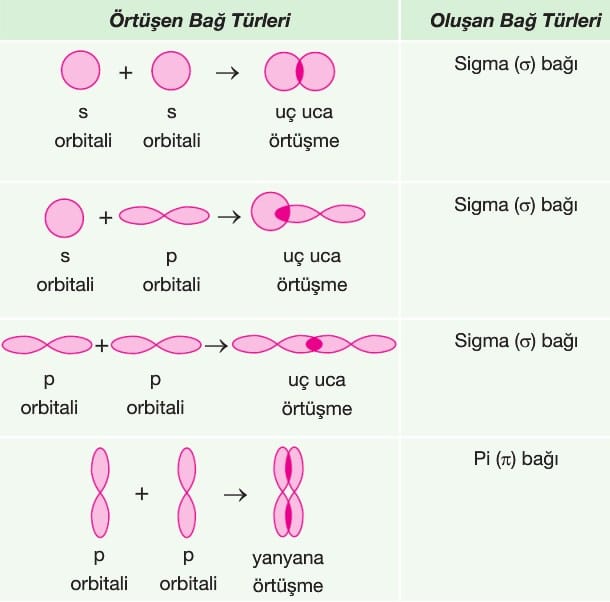
Hibrit orbitallerinin yaptığı bağlar sigma (σ) türü bağlardır.
İki atom orbitalinin (hibrit orbitali de olabilir) bağ ekseni doğrultusunda uç uca örtüşmesiyle oluşan bağ türüne sigma (σ) bağı denir.
İki atomun p orbitallerinin (p-p) bağ eksenine dik doğrultuda yanyana örtüşmesiyle oluşan bağ türüne pi (π) bağı denir.
Tekli bağların tümü sigma (σ) bağıdır. İki atom arasında sadece bir tane sigma bağı oluşur.
Çoklu bağlardan (ikili, üçlü) biri sigma diğerleri pi bağlarıdır. Bir molekülün geometrisini belirleyen sigma bağı ve ortaklanmamış elektron çiftleridir. π (pi) bağları sadece bağ uzunluğunu kısaltır.
Sigma (σ) bağı oluşmadan pi (π) bağı oluşmaz.
Sigma (σ) bağı pi (π) bağından daha sağlamdır.
Bir kimyasal tepkimede ilk önce pi (π) bağı kopar.
Molekül Geometrisi
Molekül geometrisi, bağlanmış atomların çekirdeklerinin doğru çizgilerle birleştirilmesiyle oluşan geometrik şekildir. Bağ uzunlukları ve bağ açıları üzerinde durularak molekül geometrileri belirlenir.
Molekül geometrileri, değerlik kabuğu elektron çifti itmesi (VSEPR) kuramına göre belirlenir. Bu kurama göre ortaklanmış elektron çiftleri (bağlayıcı elektron çiftleri) ile ortaklanmamış (bağ yapmayan) elektron çiftleri birbirini iter. Elektron çiftleri atom etrafındaki itmeyi en aza indirecek şekilde yönlenirler.
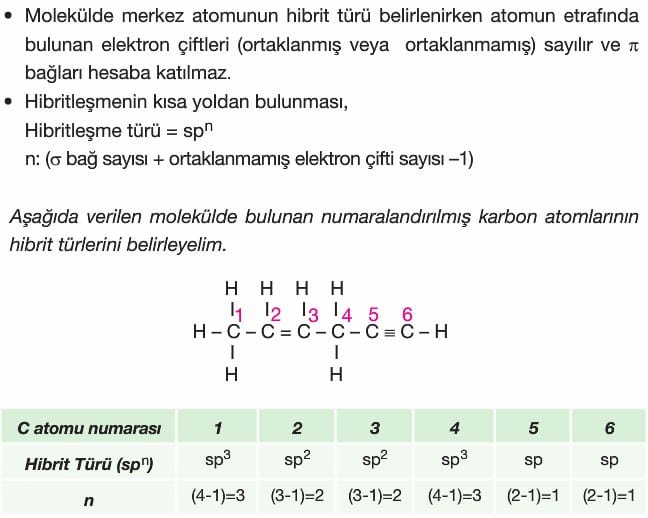
VSEPR kuramı merkez atoma iki ya da daha fazla atomun bağlandığı kovalent bağlı moleküllerde geçerlidir.
VSEPR gösteriminde merkez atom A; ortaklanmamış elektron çifti E; merkez atoma bağlı atom ya da atom grupları X ile gösterilir.
X, merkezi atomun yaptığı σ bağları sayısı da demektir.
Çözümlü Örnek Test Soruları
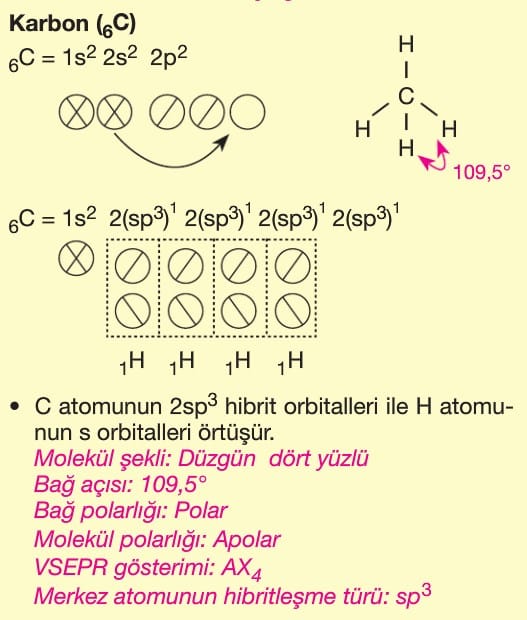
Soru 1: CH₄ (Metan) Molekülü
Soru:
CH₄ molekülündeki karbon atomunun hibritleşme türü nedir? Molekülün geometrik şekli nasıldır?
Çözüm:
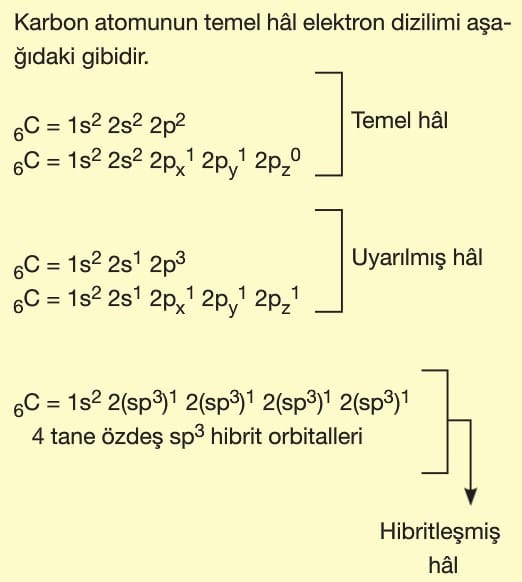
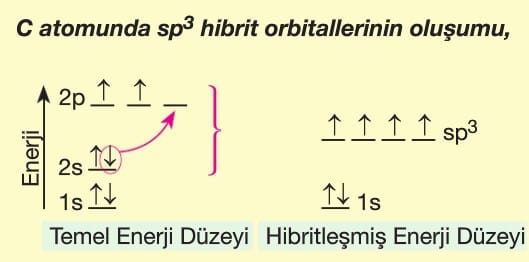
- Karbon (C) atomunun temel hal elektron dizilimi: 1s² 2s² 2p².
- Bağ yaparken 1 tane 2s orbitali ve 3 tane 2p orbitali sp³ hibritleşmesi yapar (toplam 4 hibrit orbital).
- 4 tane H atomuyla bağ yaptığı için dörtyüzlü (tetrahedral) geometri oluşur.
Cevap: sp³ hibritleşme, tetrahedral geometri.
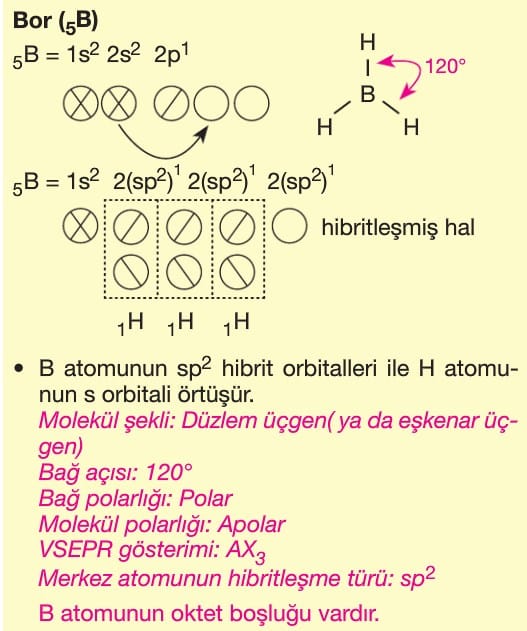
Soru 2: BF₃ (Bor Triflorür) Molekülü
Soru:
BF₃ molekülünün hibritleşme türü ve şekli nedir?
Çözüm:
- Bor (B) atomunun temel hal dizilimi: 1s² 2s² 2p¹.
- 2s orbitali ve 2 tane 2p orbitali sp² hibritleşmesi yapar (3 hibrit orbital).
- 3 tane F atomuyla bağ yapar ve düzlem üçgen (trigonal planar) geometri oluşur.
- Bağ açıları: 120°.
Cevap: sp² hibritleşme, trigonal planar geometri.
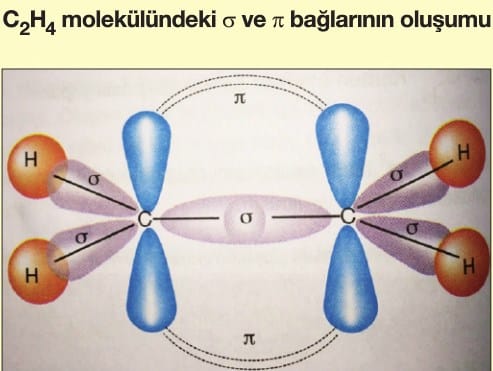
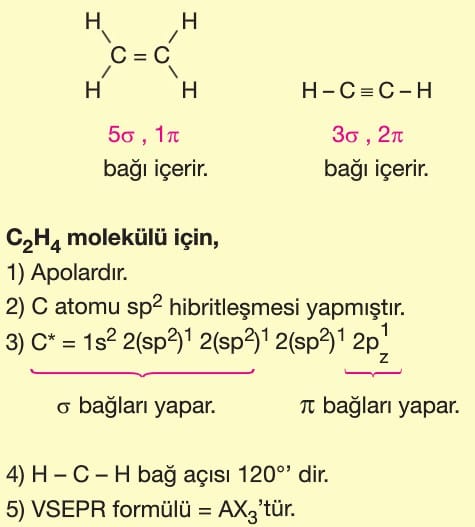
Soru 3: C₂H₄ (Eten) Molekülü
Soru:
C₂H₄’teki karbon atomlarının hibritleşme türü ve molekül geometrisi nedir?
Çözüm:
- Her bir C atomu 3 bağ yapar (1 çift bağ, 2 tek bağ).
- 1 tane 2s ve 2 tane 2p orbitali sp² hibritleşmesi yapar.
- Çift bağ nedeniyle molekül düzlemseldir ve bağ açıları ~120°.
- Geometri: Trigonal planar (H atomları ve çift bağ aynı düzlemde).
Cevap: sp² hibritleşme, trigonal planar geometri.
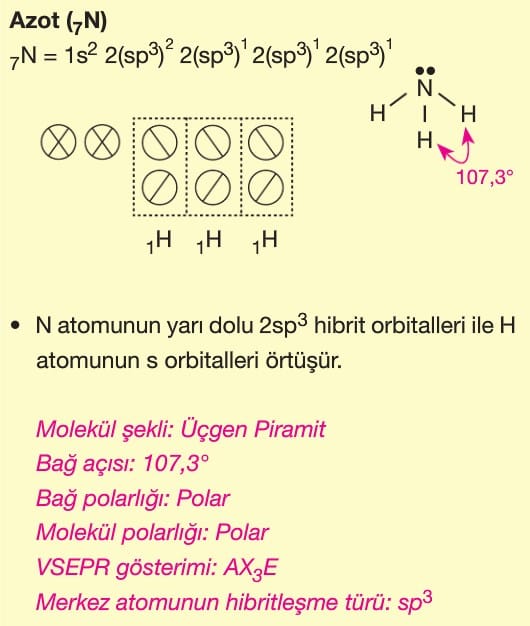
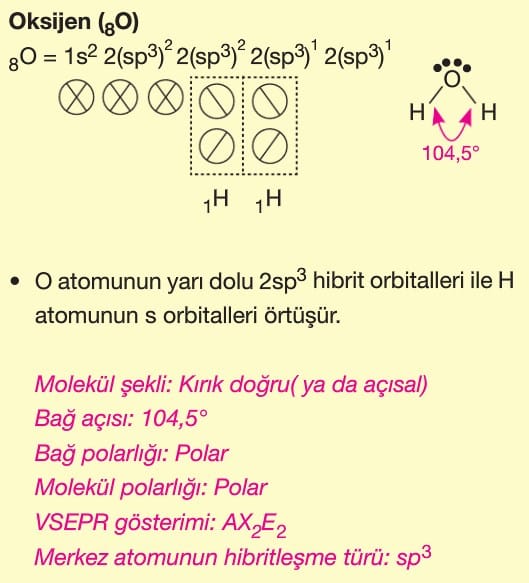
Soru 4: H₂O (Su) Molekülü
Soru:
H₂O molekülünün hibritleşmesi ve geometrik şekli nasıldır? Neden bağ açısı 109.5° değil de 104.5°’dir?
Çözüm:
- Oksijen (O) atomu sp³ hibritleşmesi yapar (2 bağ yapar, 2 çift serbest elektron bulunur).
- Geometri: Kırık doğru (bent) şeklindedir.
- Serbest elektron çiftleri bağ çiftlerini sıkıştırdığı için ideal tetrahedral açı (109.5°) 104.5°’ye düşer.
Cevap: sp³ hibritleşme, kırık doğru geometri (104.5°).
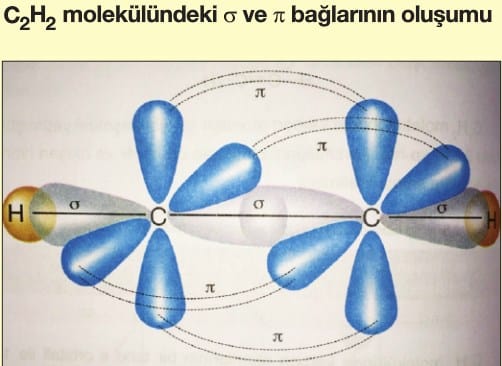
Soru 5: CO₂ (Karbon Dioksit) Molekülü
Soru:
CO₂ molekülünde hibritleşme ve molekül şekli nedir?
Çözüm:
- Karbon (C) atomu 2 tane çift bağ yapar (O=C=O).
- 1 tane 2s ve 1 tane 2p orbitali sp hibritleşmesi yapar.
- Hibritleşmeyen 2 p orbitali π bağlarını oluşturur.
- Geometri: Doğrusal (linear) (180° bağ açısı).
Cevap: sp hibritleşme, doğrusal geometri.
Özet Tablo
| Molekül | Hibritleşme | Geometri | Bağ Açısı |
|---|---|---|---|
| CH₄ | sp³ | Tetrahedral | 109.5° |
| BF₃ | sp² | Trigonal planar | 120° |
| C₂H₄ | sp² | Düzlemsel | ~120° |
| H₂O | sp³ | Kırık doğru | 104.5° |
| CO₂ | sp | Doğrusal | 180° |