Hal Değişimi 9.Sınıf Fizik Ders Notu (Yeni Müfredat)
Maddenin katı, sıvı ve gaz olmak üzere üç ana hali bulunmaktadır ve bu haller arasında geçiş yapma sürecine hal değişimi denir. Bu süreç, maddeye ısı verilmesi veya ısının alınması sonucu gerçekleşir. Örneğin, bir katının sıvıya dönüşmesi erime, sıvının buhara dönüşmesi buharlaşma, ve gazın sıvıya dönüşmesi yoğunlaşma olarak adlandırılır. Bu olaylar, madde içindeki moleküllerin enerjisindeki değişimlerle açıklanır. Hal değişimi sırasında madde sıcaklığı sabit kalır çünkü alınan veya verilen enerji moleküller arası bağların koparılması veya oluşturulması için harcanır. Bu nedenle hal değişimi, enerji dönüşümü ve moleküler hareket açısından fiziğin temel konularından biridir. Örneğin, buzun suya dönüşmesi günlük hayatta sıkça gözlemlenen bir erime sürecidir. Bu süreçler, termodinamiğin ve enerji korunumunun temel ilkeleriyle doğrudan ilişkilidir.
9. Sınıf Hal Değişimi Testleri
9. Sınıf Hal Değişimi Konu Anlatımı (Yeni Müfredat)
Bir maddeye ısı verildiğinde ya da madde ile çevresi arasında ısı alış – verişi olurken maddenin sıcaklığı değişir. Ancak ısı alış – verişi sırasında maddenin sıcaklığının değişmediği durumlar da vardır. Bu durumlar maddenin katıdan sıvıya geçmesi (erime), sıvıdan gaza geçmesi (buharlaşma), gazdan sıvıya geçmesi (yoğunlaşma), sıvıdan katıya geçmesi (donma) dır. Bu olaylara hal değişimi ya da faz değişmesi denir.
Erime:
Bir katı maddeye ısı enerjisi verildiğinde maddenin sıcaklığı dolayısıyla moleküllerinin (ya da atomlarının) titreşim genliği artar. Katının erime noktasında genlik, moleküller arasındaki bağı kırabilecek kadar büyük olur ve moleküller birbirinden uzaklaşarak madde sıvı hale geçer. Buna göre bir katının erimesi, moleküllerinin sıvı molekülleri kadar birbirinden uzaklaşmasıdır. Erime sırasında verilen ısı, moleküller arasındaki çekim kuvvetine karşı iş yapar ve moleküllerin birbirinden uzaklaşmasını sağlar. Erime süresince sıcaklık sabit kalır.
- Saf bir katı madde, belirli bir basınç altında, belirli bir sıcaklıkta erir. Bu sıcaklığa erime sıcaklığı ya da erime noktası denir.
- Erime sıcaklığında bulunan 1 gram katının aynı sıcaklıkta 1 gram sıvı olabilmesi için gereken ısıya erime ısısı denir. Le ile gösterilir. Birimi cal/g dır. Erime sıcaklığında bulunan m gram katının erimesi için gereken ısı;

- Belli basınçtaki erime sıcaklığı ve erime ısısı katıların ayırt edici özelliğidir.
- Sıvı soğutulursa, erime sıcaklığında katılaşmaya (donmaya) başlar. Erirken aldığı ısıyı donarken geri verir.
Erime sıcaklığı = Donma (katılaşma) sıcaklığı
Erime ısısı = Donma (katılaşma) ısısı - Erime sıcaklığında bir maddenin sıvısı ile katısı bir arada bulunur.
- Basınç değişirse erime noktası değişir. Maddenin erirken hacmi küçülüyorsa (buz gibi) basıncın artması, hacmin küçülmesini kolaylaştıracağından erime noktası düşer.
- Maddenin erirken hacmi büyüyorsa (Al, Au, Ag, Cu gibi) basıncın artması hacmin büyümesini zorlaştıracağından erime noktası yükselir.
- Sıvı içinde çözünen yabancı maddeler donma noktasını düşürür.
Donma:
Maddenin sıvı halden katı hale geçişidir. Donma sıcaklığı, bir madde için belirli bir sabit değerdir. Sıvı moleküller, belirli bir sıcaklıkta termal enerji kaybederek katı hale dönüşür.
Buharlaşma:
Bir sıvının ya da katının gaz haline geçmesine buharlaşma, buharlaşma sırasında oluşan gaza da buhar denir. Buharlaşma her sıcaklıkta olur. Bunun nedeni, madde yüzeyindeki moleküllerin bir kısmının maddeyi terk etmeye yetecek büyüklükte hıza sahip olmasıdır. Moleküllerin hızları sıcaklıkla arttığından maddeyi birim zamanda terk eden moleküllerin sayısı yani buharlaşma hızı sıcaklıkla artar.
Kaynama (Yoğunlaşma):
Sıvı molekülleri birbirine gazlarınkine göre daha yakındır. Bu nedenle sıvı moleküllerinin birbirine uyguladıkları çekim kuvveti, gaz moleküllerinin birbirine uyguladıkları çekim kuvvetinden daha büyüktür. Kaynama sırasında verilen, ısı, sıvı molekülleri arasındaki bağı kırarak moleküllerin birbirinden uzaklaşmasını sağlar. Yani kaynama sırasında verilen ısı, sıvı molekülleri arasındaki çekim kuvvetinin yenilmesine harcanır. Kaynama, bir sıvının hızlı ve içten buharlaşmasıdır. Bir sıvı, buhar basıncının dış basınca eşit olduğu sıcaklıkta kaynamaya başlar ve kaynama süresince sıcaklık sabit kalır.
- Saf bir sıvı belirli bir basınç altında belirli bir sıcaklıkta kaynar. Bu sıcaklığa kaynama sıcaklığı ya da kaynama noktası denir.
- Belirli bir basınç ve sıcaklıkta 1 gram sıvının yine aynı sıcaklıkta 1 gram buhar olabilmesi için gereken ısıya buharlaşma ısısı denir. Lb ile gösterilir. Birimi cal/g dır. Buna göre m gram sıvının kaynama süresince aldığı ısı;
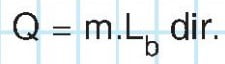
- Belli basınçtaki kaynama sıcaklığı ve buharlaşma ısısı sıvıların ayırt edici özelliğidir.
- Buhar soğutulursa yoğunlaşır. Buharlaşırken aldığı ısıyı yoğunlaşırken geri verir.
- Basınç artarsa kaynama noktası yükselir.
- Bir sıvı içinde çözünen yabancı maddeler kaynama noktasını yükseltir.
Saf Bir Katı Maddenin Hal Değişimi Grafiği
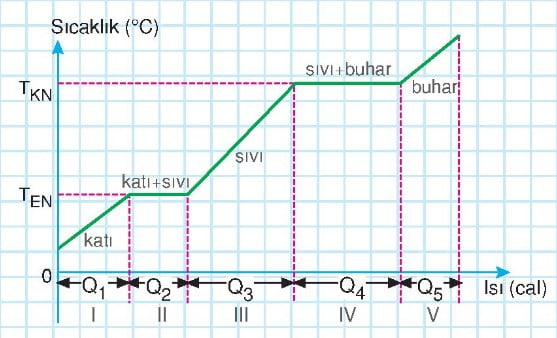

- Sıcaklığı değişen bir maddenin moleküllerinin kinetik enerjisi, hal değişimi yapan bir maddenin moleküllerinin potansiyel enerjisi değişir.
- Bir maddenin katı halden sıvı hale, sıvı halden gaz hale geçerken öz kütlesi değişir.
- Hal değişikliği sırasında maddenin sıcaklığı değişmediğinden kapta geriye kalan maddenin öz kütlesi değişmez.
- Hal değişikliği yapan maddelerde erime ve kaynama süreleri madde miktarına bağlıdır.
Çözümlü Örnek Sorular:
Örnek 1:
Soru: 200 gram buzun erimesi için ne kadar ısı gerekir? Buzun erime ısısı 334 J/g’dir.
Çözüm: Buzun erimesi için gereken ısıyı bulmak için hal değişim ısısı formülünü kullanırız.
Q = m * Le
- m = 200 gram = 0.2 kg
- Le = 334 J/g
Q = 200 g * 334 J/g
Q = 66800 J
200 gram buzun tamamen erimesi için 66800 joule ısı gerekir.
Örnek 2:
Soru: 1.5 kg suyun tamamını buharlaştırmak için ne kadar ısı gerekir? Suyun buharlaşma ısısı 2260 J/g’dir.
Çözüm: Suyun buharlaşması için gereken ısıyı bulmak için yine hal değişim ısısı formülünü kullanırız.
Q = m * Lv
- m = 1.5 kg = 1500 gram
- Lv = 2260 J/g
Q = 1500 g * 2260 J/g
Q = 3390000 J
1.5 kg suyun tamamen buharlaşması için 3390000 joule ısı gerekmektedir.
Örnek 3:
Soru: 300 gram su, 100°C sıcaklıkta bulunuyor. Suyu buharlaştırmak için kaç joule ısı gereklidir? (Suyun buharlaşma ısısı 2260 J/g)
Çözüm:
Q = m * Lv
- m = 300 g
- Lv = 2260 J/g
Q = 300 g * 2260 J/g
Q = 678000 J
300 gram suyu tamamen buharlaştırmak için 678000 joule ısı gerekir.
Çözümlü Örnek Test Soruları
1. Soru
Ahmet, buzdolabından çıkardığı bir buz küpünü açık bir kapta bıraktığında, bir süre sonra buzun tamamen suya dönüştüğünü gözlemliyor. Bu sırada buzun sıcaklığı sürekli olarak sabit 0 °C’de kalmıştır. Bu olay hakkında aşağıdaki ifadelerden hangisi doğrudur?
A) Hal değişimi sırasında buzun sıcaklığı artar.
B) Erime işlemi sırasında madde dışarıya ısı verir.
C) Buz, suya dönüşürken moleküller arası bağlar kopar.
D) Hal değişimi sırasında buzun sıcaklığı düşer.
E) Hal değişimi sırasında buzun kütlesi azalır.
Cevap: C
Çözüm: Hal değişimi sırasında madde sıcaklığı sabit kalır. Alınan ısı, moleküller arası bağların koparılması için harcanır. Bu nedenle doğru cevap C’dir.
2. Soru
Bir miktar su, 80 °C’de bir kapta ısıtılmaktadır. Bir süre sonra su kaynamaya başlar ve kaynama sırasında sıcaklık sabit kalır. Bu olayın sebebi nedir?
A) Su, kaynama sırasında dışarıya enerji verir.
B) Kaynama sırasında su molekülleri ısı alarak hızlanır.
C) Kaynama, yalnızca moleküller arası çekim kuvvetlerini artırır.
D) Kaynama sırasında alınan enerji, molekülleri gaz fazına geçirmek için harcanır.
E) Su, kaynama sırasında moleküler bağlarını güçlendirir.
Cevap: D
Çözüm: Kaynama sırasında sıcaklık sabit kalır. Alınan enerji, moleküllerin gaz fazına geçmesi için harcanır. Bu nedenle doğru cevap D’dir.
3. Soru
Bir öğrenci, saf bir maddeyi ısıttığında sıcaklık-zaman grafiğinin belirli bir bölgesinde sıcaklık değişmediğini fark etmiştir. Bu durum aşağıdaki hangi olayın gerçekleştiğini gösterir?
A) Maddenin ısı alıp katılaşması
B) Maddenin hal değiştirip enerji depolaması
C) Maddenin ısı alıp buharlaşması
D) Maddenin yoğunlaşma sürecine girmesi
E) Maddenin sıcaklık kaybederek erimesi
Cevap: C
Çözüm: Saf bir maddenin hal değiştirdiği sırada sıcaklık sabit kalır. Bu nedenle ısı enerjisi, moleküller arası bağların kopması için harcanır. Doğru cevap C’dir.
4. Soru
Eren, bir su dolu kabı ocakta kaynatmaya başlamıştır. Suyun tamamen buharlaşması için ne kadar süre geçtiğini hesaplamak istemektedir. Aşağıdaki faktörlerden hangisi bu süreyi etkilemez?
A) Kabın açık mı yoksa kapalı mı olduğu
B) Ocağın verdiği ısı enerjisinin miktarı
C) Suyun başlangıçtaki sıcaklığı
D) Kabın içindeki su miktarı
E) Suyun buharlaşırken sıcaklık değişimi
Cevap: E
Çözüm: Buharlaşma sırasında sıcaklık sabit kalır. Bu yüzden sıcaklık değişimi süreci etkilemez. Doğru cevap E’dir.
5. Soru
Bir öğrenci, 1 kg saf buzu tamamen eritmek için gerekli olan enerjiyi hesaplamak istemektedir. Saf buzun erime ısısı 334 J/g olduğuna göre, aşağıdaki işlemlerden hangisi bu enerjiyi doğru hesaplar?
A) 334 × 100
B) 334 × 1000
C) 334 ÷ 1000
D) 334 ÷ 100
E) 334 + 1000
Cevap: B
Çözüm: Buzun erime ısısı gram başına verilmiştir. 1 kg = 1000 gram olduğundan gerekli enerji, 334 × 1000 = 334000 J olacaktır. Doğru cevap B’dir.