Gazların Özellikleri ve Gaz Yasaları 11. Sınıf Kimya
Gazlar birbirinden bağımsız hareket eden taneciklerdir. Bulundukları ortamda gelişigüzel ve doğrusal hareket ederler. Bulundukları kabın hacmini ve şeklini alırlar. Bu nedenlerle içinde bulundukları kabın her yerine aynı etkiyi yaparlar. Örneğin, özdeş iki kaptan birine gaz diğerine sıvı doldurulduğunda, içinde gaz bulunan kabın her yerinde basınç aynı iken, içi sıvı dolu kabın tabanındaki basınç diğer noktalardakinden fazladır.
Gazların özelliklerini maddeler halinde sıralarsak;
- Gaz tanecikleri arasında büyük boşluklar vardır.
- Her oranda homojen karışırlar.
- Bulundukları kabın her yerine aynı basıncı uygularlar.
- Moleküller arası boşluklar çok olduğu için sıkıştırılabilir.
- Akışkandırlar.
- Gelişigüzel, düzensiz ve sürekli hareket ederler. (Brown hareketi)
- Öteleme, dönme ve titreşim hareketi yaparlar.
BİLGİ: Maddenin Plazma Hali: Oda sıcaklığında maddenin katı, sıvı ve gaz hali bulunur. Koşullar farklılaştığında dördüncü fiziksel halinden bahsedebiliriz. Maddenin plazma hali gaz halinin bir üst basamağıdır. Eğer gazın sıcaklığı çok yüksek hale getirilir ise, gaz molekülleri önce atomlara sonra da katyonlara dönüşür. Aynı zamanda serbest elektronlar oluşur. Oluşan bu karışıma maddenin plazma hali denir. Toplamda katyon, elektron ve nötr atomlardan oluşur. Katyon ve elektron sayısı eşit olduğu için ortam nötrdür. Plazma haline Güneş, magma, şimşek ve ateşin ucundaki kor örnek verilebilir.
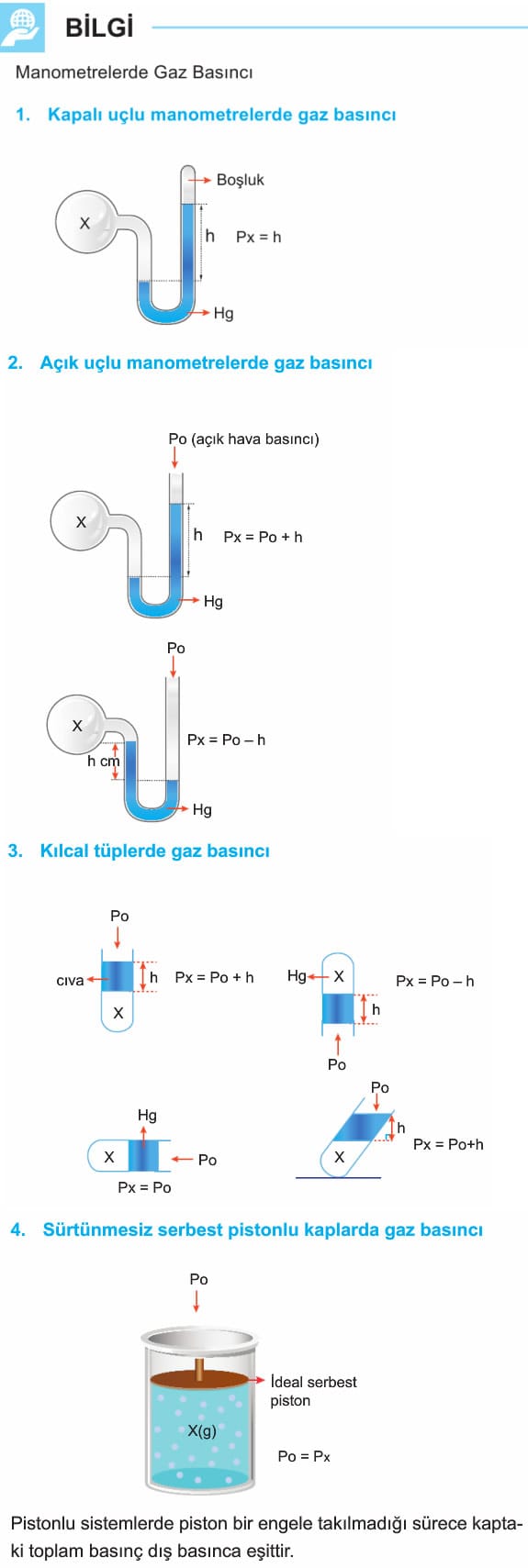
GAZ BASINCININ ÖLÇÜLMESİ
Gaz basıncı farklı birimlerde ifade edilebilir. Gaz basıncını bulunduğu koşullarda kabın her noktasına uyguladığı kuwet olarak tanımlayabiliriz.
Basınç birimleri
– paskal (Pa)
– atmosfer (atm)
– Torr
– bar
– mmHg
Paskal (Pa): 1 m2 lik yüzeye 1 Newton(N) luk kuvvetin dikey olarak etki etmesi sonucu oluşan basınca denir.
1 Pa =1 N/m2
Amtosfer (atm): Yaygın olarak kullanılan basınç birimlerindendir. 760 mmHg lik basınç 1 atm’lik basınca eşittir.
Bar: 1 mmz lik yüzeye 0,1 Newtonluk kuvvetin dikey olarak etki etmesi sonucu oluşan basınçtır.
1 Bar = 0,1 N/mm2
1 bar = 105 paskal
1 atm = 101325 Nm-2
1 atm = 101325 Pa
1 atm = 760 mmHg
Gazlarda hacim birimleri litre veya m3 olarak kullanılır.
1L = 1 dm3
1000L=1 m3
Atmosfer Basıncının ölçülmesi
Havanın ağırlığı nedeni ile yeryüzüne uyguladığı kuvvete atmosfer basıncı, bir başka ifadeyle açık hava basıncı denir.
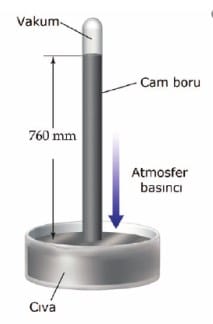
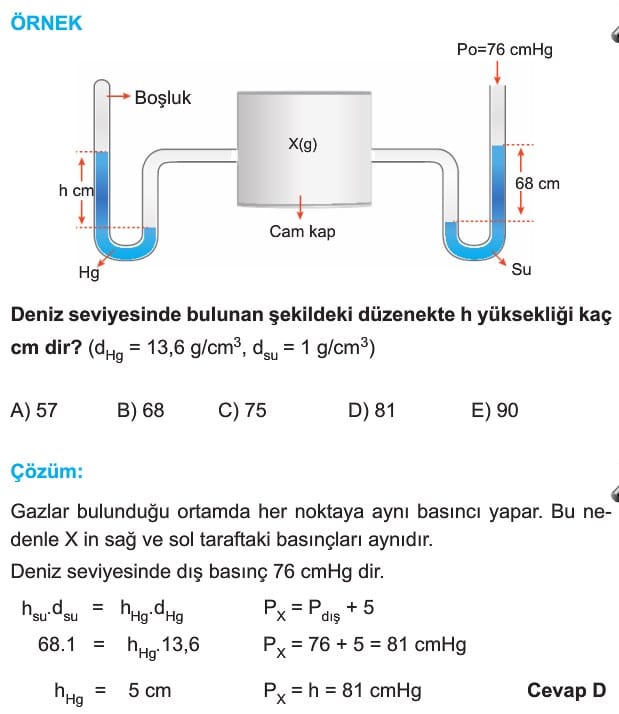
Açık hava basıncı Toriçelli deneyi ile hesaplanmıştır. Toriçelli, deneyinde cıva dolu bir kaba yine İçi cıva ile dolu olan 1 metrelik cam boruyu ters çevirerek daldırmıştır. Cam borudaki cıvanın yüksekliği 760 mm olduğunda cıva yüksekliğinin sabitlendiğini görmüştür. Açık hava basıncını ölçen alete barometre denir. Kapalı kaplardaki gaz basıncını ölçen alete manometre denir.
Bu çalışmayı deniz seviyesinde yaptığı İçin, deniz seviyesindeki atmosfer basıncı
760 mmHg = 76 cmHg = 760 Torr = 1 atm dir.
Bu deneyde cıva kullanılmasının iki nedeni vardır:
- Özkütlesi en yüksek olan akışkandır.
- Buharlaşmanın en az olduğu akışkandır.
Eğer buharlaşma fazla olursa cam boru içinde oluşan buhar sıvıyı aşağıya itecektir ve atmosfer basıncının ölçülmesinde hata oluşacaktır.
GAZ KANUNLARI
Gazların bulundukları kaba yapacakları basınç; gazın hacim, sıcaklık, mol sayısı arasındaki ilişkiye bağlıdır. Bu etkiler deneysel yollarla bulunan bazı kanunlarla açıklanır.
(Basınç:P, Hacim: V, Sıcaklık: T, Mol sayısı: n)
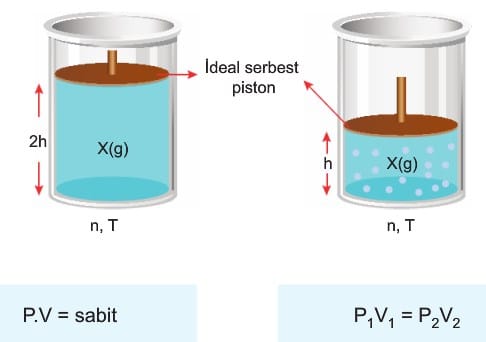
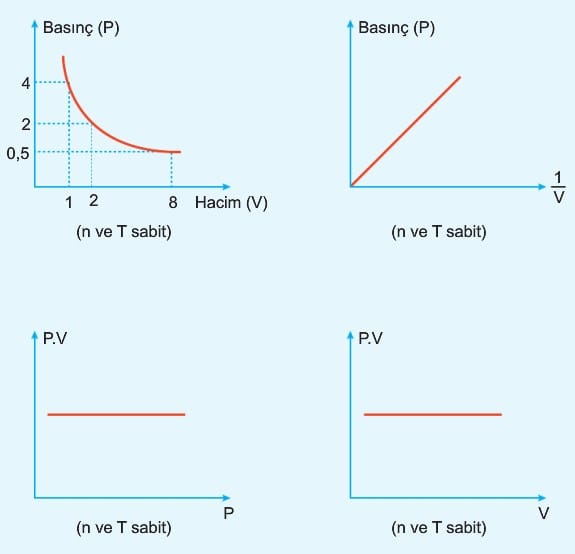
1. Boyle – Mariotte Kanunu: (Basınç – Hacim ilişkisi)
Miktarı ve sıcaklığı sabit tutulan ideal gazın hacmi ile basıncı ters orantılıdır. Bir başka ifadeyle basınç, hacim çarpımı her zaman sabittir.
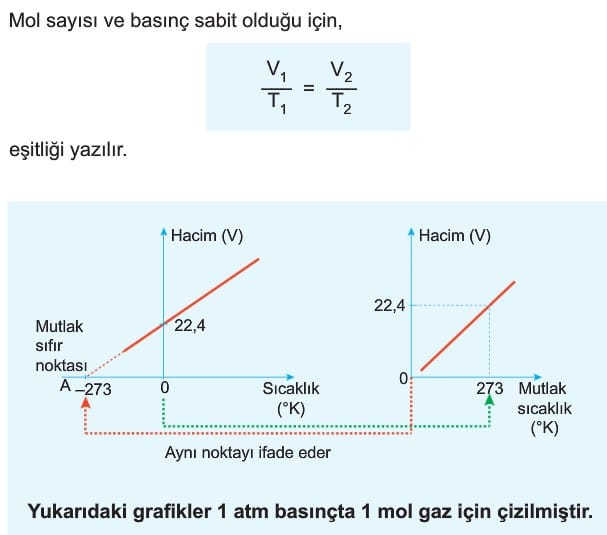
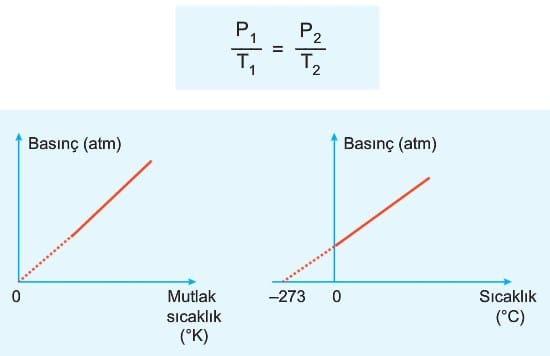
2. Charles Kanunu (Sıcaklık – Hacim İlişkisi)
Sabit basınçtaki miktarı sabit olan ideal gazın hacmi mutlak sıcaklığı ile doğru orantılıdır. Burada mutlak sıcaklığı açıklamadan önce mutlak sıfır noktasını açıklayalım. Mutlak sıfır noktası, Termodinamiğin III. kanununa göre entropinin (düzensizliğin) sıfır olduğu sıcaklıktadır. Bir başka ifadeyle gaz hacminin sıfır olduğu sıcaklıktır. Bu değer -273 °C veya 0 °K olarak ifade edilir.
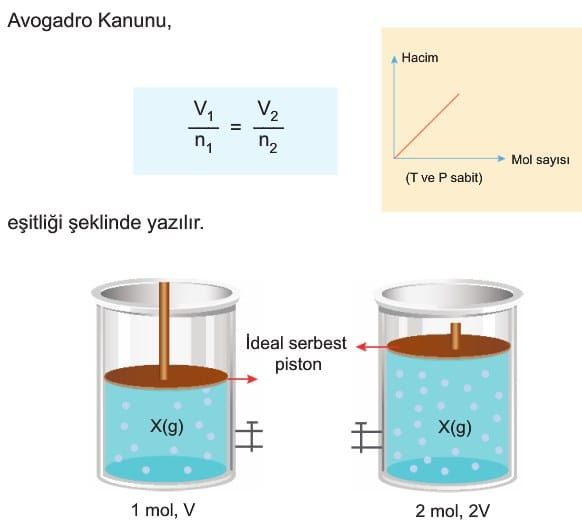
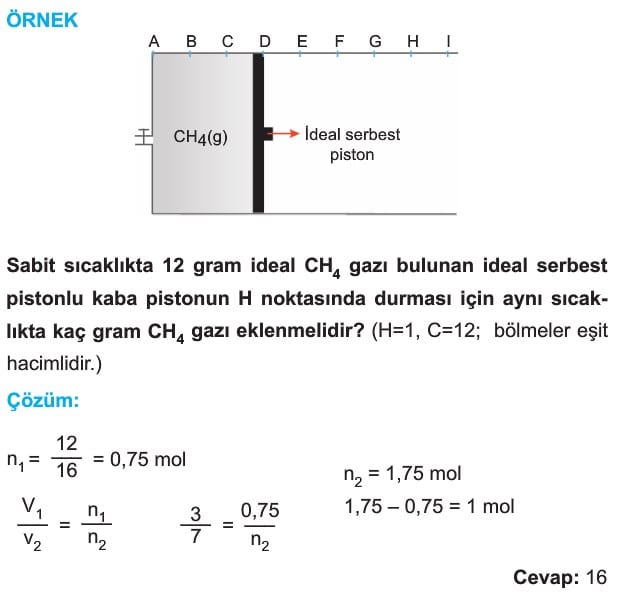
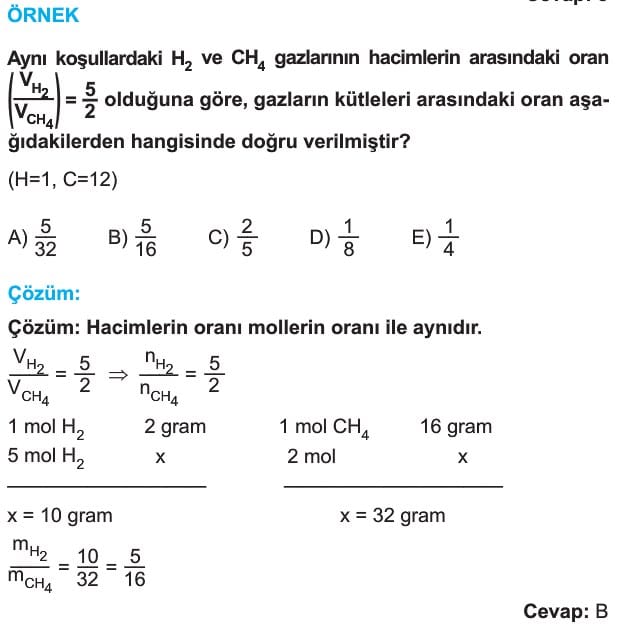
3. Avogadro Kanunu (Mol sayısı – Hacim İlişkisi)
Sabit sıcaklık ve basınçta ideal gazların mol sayısı ile hacmi doğru orantıdır.
Bilgi:
Normal koşullar: 0 °C ve 1 atm basınç
Standart şartlar: 25 °C ve 1 atm basınç
Normal koşullarda 1 mol ideal gaz 22,4 L hacim kaplar.
4. Sıcaklık – Basınç İlişkisi (Gay – Lussac Kanunu)
Hacmi ve mol sayısı sabit olan ideal gazın basıncı mutlak sıcaklıkla doğru orantılıdır.
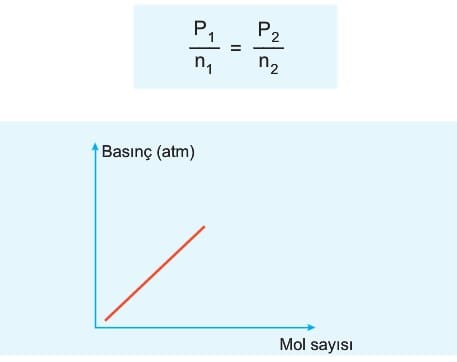
5. Mol sayısı- Basınç İlişkisi (Dalton Kanunu)
Sabit hacim ve sıcaklıktaki ideal gazın basıncı mol sayısı ile basıncı doğru orantılıdır.
Gazların Özellikleri ve Gaz Yasaları Soruları ve Çözümleri
Çözümlü Örnek Test Soruları
Gazlar, sıkıştırılabilir olmaları, hareketli taneciklerden oluşmaları ve yüksek difüzyon hızları gibi birçok özelliğiyle bilinir. Bu özellikler, gazların basınç, hacim ve sıcaklık gibi değişkenler altında nasıl davrandığını anlamamıza yardımcı olan gaz yasalarıyla açıklanır.
1. Bir balonun içinde 2 mol ideal gaz bulunmaktadır. Balonun hacmi 10 litre ve basıncı 2 atm iken, balonun sıcaklığı artırılarak hacmi iki katına çıkarılıyor. Bu durumda, basınç nasıl değişir ve yeni basınç değeri kaç olur? (Gaz sıcaklığı Kelvin cinsinden hesaplanmalıdır)
A) 1 atm
B) 0,5 atm
C) 2 atm
D) 4 atm
Çözüm: Gaz yasalarına göre, sıcaklık arttığında ve hacim iki katına çıktığında basınç, hacimle ters orantılı olarak azalır. Burada hacim iki katına çıkarıldığı için basınç yarıya iner. Bu durumda basınç 1 atm olur. Cevap A.
2. İki kapalı kapta aynı sıcaklıkta bulunan iki farklı gaz türü mevcuttur. Kaplardan birindeki gazın molekülleri diğerine göre daha büyük kütleye sahiptir. Bu durumda, iki gazın sahip olduğu ortalama kinetik enerjileri ve hızları hakkında ne söylenebilir?
A) Daha büyük kütleli gazın kinetik enerjisi daha fazladır.
B) İki gazın da kinetik enerjisi aynıdır, ancak hafif gazın hızları daha fazladır.
C) Daha küçük kütleli gazın kinetik enerjisi daha azdır.
D) İki gazın kinetik enerjisi ve hızları aynıdır.
Çözüm: Kinetik teoriye göre, aynı sıcaklıkta bulunan gazların ortalama kinetik enerjileri eşittir, ancak kütlesi daha küçük olan gazın molekülleri daha hızlı hareket eder. Bu nedenle cevap B’dir.
3. Bir balona sürekli olarak hava üfleniyor ve balonun hacmi zamanla artıyor. Eğer sıcaklık sabit tutuluyorsa, hacim artışı devam ettikçe balonun içindeki gazın basıncı nasıl değişir ve bu durumu hangi gaz yasası açıklar?
A) Basınç artar, Boyle yasası
B) Basınç azalır, Boyle yasası
C) Basınç sabit kalır, Charles yasası
D) Basınç azalır, Charles yasası
Çözüm: Sıcaklık sabitken hacim arttıkça, basınç ters orantılı olarak azalır. Bu durum Boyle yasası ile açıklanır. Cevap B.
4. Bir tüp içerisinde bulunan gazın sıcaklığı sabit tutulmaktadır. Tüpün hacmi kısmen azaltıldığında gazın basıncı aniden artmıştır. Bu basınç artışını kinetik teori açısından açıklamak gerekirse, gaz taneciklerinin hangi davranışından kaynaklandığını söyleyebiliriz?
A) Taneciklerin sayısının azalmasından
B) Taneciklerin çarpışma sıklığının artmasından
C) Taneciklerin hızlarının artmasından
D) Taneciklerin kütlelerinin artmasından
Çözüm: Kinetik teoriye göre, hacim azaldığında tanecikler aynı hızla hareket etmeye devam eder, ancak daha küçük bir hacimde oldukları için çarpışma sıklıkları artar. Bu da basıncın artmasına neden olur. Cevap B.
5. Sabit sıcaklıkta bir gazın hacmi 5 litreden 2 litreye düşürüldüğünde, gazın basıncı başlangıç basıncının kaç katı olur? (İdeal gaz yasasına göre düşününüz)
A) 2,5 katı
B) 1,5 katı
C) 3 katı
D) 5 katı
Çözüm: Boyle yasasına göre, sıcaklık sabit olduğunda hacim ile basınç ters orantılıdır. Hacim 5 litreden 2 litreye düşerse, basınç 5/2 katına çıkar. Cevap C.
6. Bir gazın sıcaklığı mutlak sıfıra (0 K) yaklaştıkça gaz moleküllerinin kinetik enerjisi ve gazın basıncı nasıl değişir?
A) Kinetik enerji artar, basınç azalır
B) Kinetik enerji azalır, basınç artar
C) Kinetik enerji sıfıra iner, basınç azalır
D) Kinetik enerji sabit kalır, basınç artar
Çözüm: Sıcaklık mutlak sıfıra yaklaştıkça gaz moleküllerinin kinetik enerjisi sıfıra iner ve basınç da azalır. Cevap C.