Gazları Tanımlayan Özellikler 9. Sınıf Kimya
GAZLARIN GENEL ÖZELLİKLERİ
- Maddenin en düzensiz halidir.
- Tanecikler arası uzaklık katı ve sıvılara göre fazla, tanecikler arası çekim daha azdır.
- Yoğunlukları katı ve sıvılardan küçüktür.
- Gaz tanecikleri titreşim dönme ve öteleme hareketi yaparlar.
- Gazlar bulundukları kabı tamamen doldururlar, kabın şeklini ve hacmini alırlar.
- Gazlar düşük sıcaklıklarda sıkıştırılarak sıvılaştırılabilirler.
- Gazlar birbiriyle daima homojen karışım oluştururlar.
Gazları niteleyen 4 özellik vardır.
- Basınç (P)
- Hacim (V)
- Sıcaklık(T)
- Miktar (n)
Basınç (P)
Gazlar sürekli hareket hâlindedir ve bulundukları kabı doldururlar. Kabın çeperleri ile esnek çarpışma yaparlar. Bu sayede kabın iç yüzeyine bir basınç uygulanır. Bu çarpışmaların tümüne birden gaz basıncı denir.
UNUTMAYALIM: Gaz moleküllerin hareket hızı sıcaklık ve molekül kütlesi ile değişir.
Gaz basıncı, P = F/A şeklinde gösterilir. F kuvvet, A yüzeyi temsil eder. Kuvvetin birimi N, alanın birimi m2 dir. Gaz basıncının birimi N/m2 dir. Bu birim Pascal (Pa) adını alır.
Toriçelli 1644 yılında hava basıncını ölçmek için içi cıva dolu yaklaşık olarak 1 m uzunluğunda bir ucu kapalı cam boruyu içi cıva dolu kap içerisine ters daldırarak bir düzenek kurmuş ve ters çevrilen cam boru içerisindeki cıva seviyesinin belirli bir yükseklikte kaldığını gözlemlemiştir. Bu düzeneğe barometre adı verilir.
Deniz seviyesinde atmosfer basıncı 1 atm kabul edilmiştir.
1 atm = 760 cmHg = 760 torr
HACİM
Maddenin boşlukta kapladığı yere hacim denir.
Gazların hacimleri sıcaklık ve basınç koşullarına bağlı olarak değişir. Gazların basıncı hacmi ile ters orantılı, mutlak sıcaklığı ile doğru orantılıdır. NK’da (0oC de ve 1 atm’lik basınçta) 1 mol gaz 22,4 litre hacim kaplar. Oda koşullarında (25oC’de 1 atm’lik basınçta) 1 mol gaz 24,5 litre hacim kaplar.
Gazların hacmi; metreküp, (m3), litre (L), desimetreküp (dm3), santimetreküp (cm3), mililitre (mL) birimiyle ifade edilirken en çok kullanılan hacim birimi litredir.
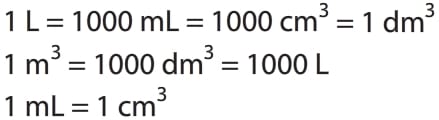
SICAKLIK
Isı ile sıcaklık çoğu zaman birbirine karıştırılan iki kavramdır.
Bugün hava ısısı 15oC dendiği anda yanlış bir açıklama yapılmış olur. Çünkü ısı bir enerji çeşitidir, buna bağlı olarak birimi de kalori, joule gibi birimlerdir.
Isı ölçen araçlara kalorimetre, sıcaklık ölçen araçlara da termometre denir.
Sıcaklık : Bir maddenin moleküllerinin ortalama kinetik enerjileri toplamı ile doğru orantılı bir büyüklüktür.
Gazlarda yapılan hesaplamalarda kelvin sıcaklık birimi kullanılır.
MİKTAR
Gazların miktarını belirtmek için mol sayısı kullanılır. Avogadro sayısı kadar (602.103) tanecik içeren madde miktarına 1 mol denir. Mol sayısı “n” harfi ile gösterilir.
1 mol gazın toplam kütlesine de mol kütlesi denir. (MA)

Çözümlü Test Soruları
1. Gazların genel özellikleriyle ilgili hangisi yanlıştır?
A) Bulundukları kabın hacmini alırlar
B) Tanecikleri arasındaki boşluk çok azdır
C) Sıkıştırılabilirler
D) Akışkandırlar
Çözüm:
Gaz tanecikleri arasındaki boşluk çok fazladır, bu sayede sıkıştırılabilirler. Doğru cevap B‘dir.
2. Aşağıdaki ifadelerden hangisi gaz basıncını tanımlar?
A) Gaz taneciklerinin kütlesi
B) Gaz taneciklerinin kabın çeperine uyguladığı kuvvet
C) Gazın hacminin sıcaklığa oranı
D) Gazın özkütlesi
Çözüm:
Gaz basıncı, taneciklerin birim yüzeye uyguladığı kuvvettir. Doğru cevap B‘dir.
3. Gazların sıkıştırılabilme özelliği hangi temel özellikle açıklanır?
A) Taneciklerin hızlı hareketi
B) Tanecikler arası boşlukların fazla olması
C) Taneciklerin çok küçük olması
D) Kimyasal tepkimeye girebilmesi
Çözüm:
Gazların sıkıştırılabilirliği, tanecikler arasındaki büyük boşluklar sayesinde mümkündür. Doğru cevap B‘dir.
4. Hangisi gazların ayırt edici özelliklerinden biri değildir?
A) Yoğunluk
B) Difüzyon hızı
C) Özkütle
D) Erime noktası
Çözüm:
Erime noktası katıların ayırt edici özelliğidir. Gazlar için difüzyon hızı ve yoğunluk ayırt edicidir. Doğru cevap D‘dir.
5. Aynı sıcaklıktaki O₂ ve He gazları için hangisi doğrudur?
A) Özkütleleri eşittir
B) Difüzyon hızları eşittir
C) Kinetik enerjileri eşittir
D) Basınçları eşittir
Çözüm:
Aynı sıcaklıktaki tüm gazların ortalama kinetik enerjileri eşittir (Kinetik Teori). Doğru cevap C‘dir.
6. Gazların yayılma hızı (difüzyon) hangisine bağlıdır?
A) Molekül ağırlığı
B) Molekül sayısı
C) Kabın şekli
D) Gazın rengi
Çözüm:
Graham Difüzyon Kanunu’na göre yayılma hızı molekül kütlesi ile ters orantılıdır. Doğru cevap A‘dır.
Bence gayet yeterli ellerinize sağlık
emeğiniz için ellerinize sağlık ama biraz kısa olmuş, yani bilgi eksikliği var.