Gazlarda Kinetik Teori 11. sınıf kimya
Kinetik Teori: Gazların davranışlarını inceleyen teoridir. Kinetik teorinin varsayımları,
- Gaz taneciklerinin hacmi çok küçüktür. Bu nedenle kabın hacmi yanında ihmal edilir.
- Gazlar öteleme hareketi yapar. Gaz taneciklerinin birbiri ve kabın yüzeyi ile yaptığı çarpışmalar esnektir. Bir başka ifadeyle enerji değişimi yok kabul edilir.
- Gaz molekülleri arasındaki itme ve çekme kuvveti ihmal edilir.
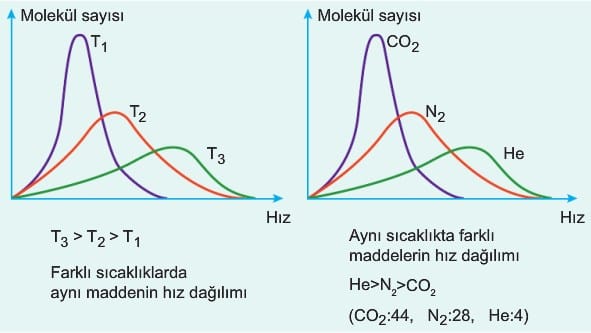
- Aynı sıcaklıktaki gazların ortalama kinetik enerjileri aynı kabul edilir. Gazların kinetik enerjisi mutlak sıcaklık ile doğru orantılıdır.

Aynı kaptaki gaz tanecikleri birbirleri ile çarpıştıklarında enerji değişimi olsa da ortalama kinetik enerji aynı kalacaktır.
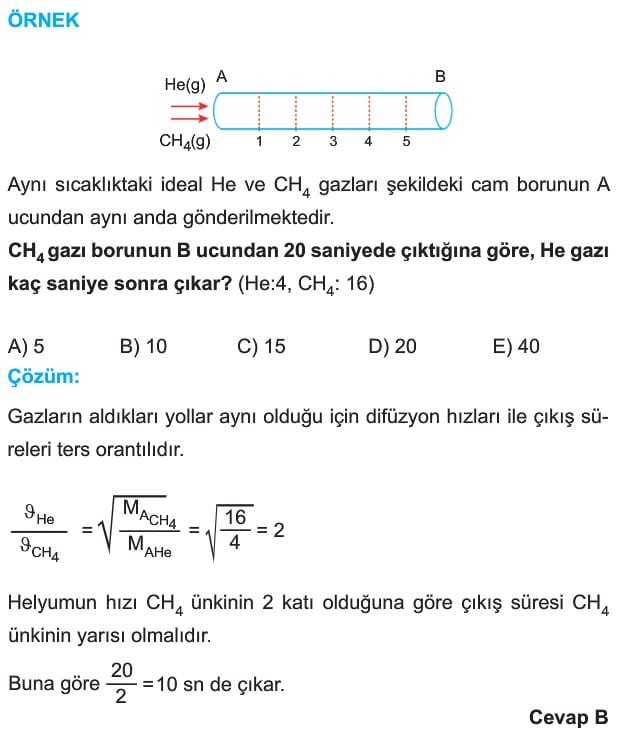
GRAHAM DİFÜZYON YASASI
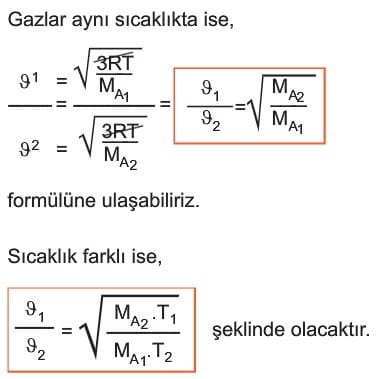
Gazların kinetik enerjisinin sıcaklığa bağlı olduğunu söylemiştik. Bu durumda
Buradan gazların hızının mutlak sıcaklığının karekökü ile doğru, molekül kütlesinin karekökü ile ters orantılı olduğu sonucuna ulaşılır.
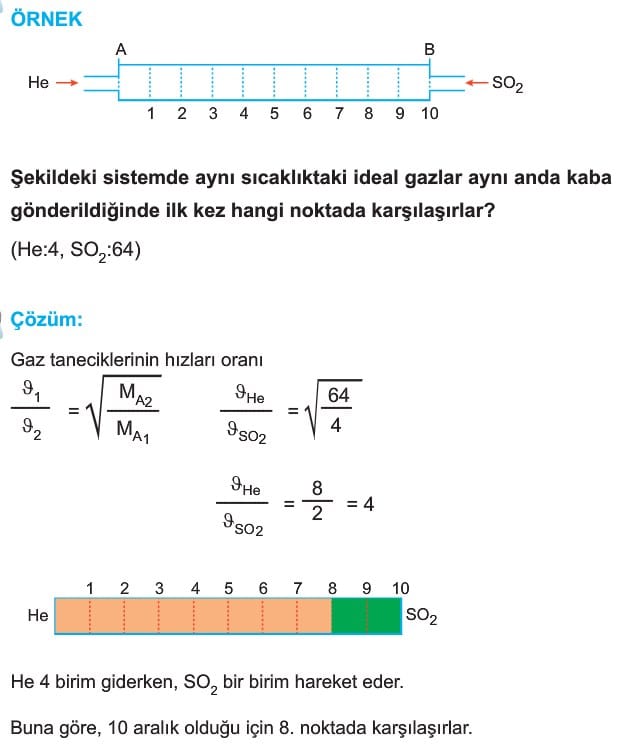
İki gazın hızları oranı ise
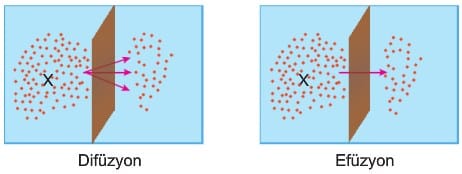
Gazların Efüzyonu
Basınç altındaki bir gazın kaptaki küçük bir delikten geçerek dışarıya yayılmasına efüzyon denir. Difüzyondan farklı olmasına rağmen hız bağıntısı Graham difüzyon yasası ile aynı verilmiştir.
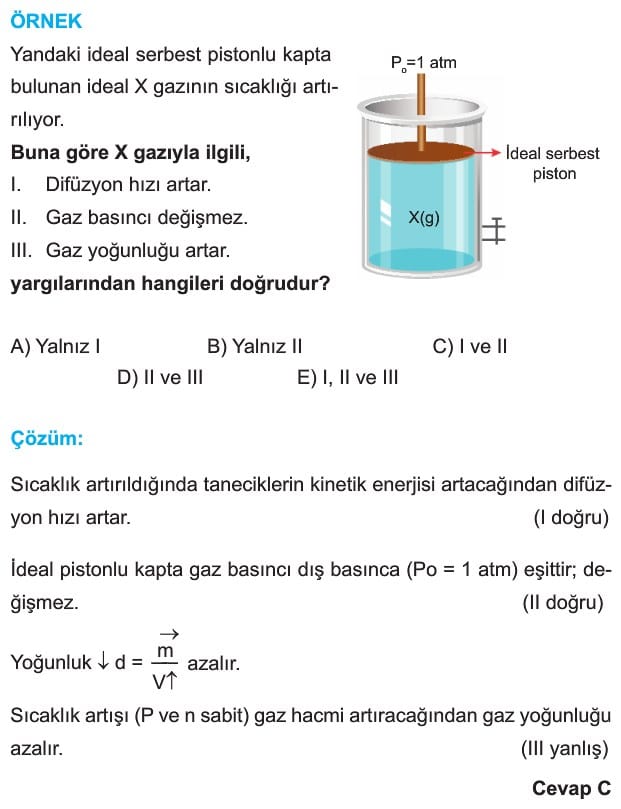
İDEAL VE GERÇEK GAZLAR
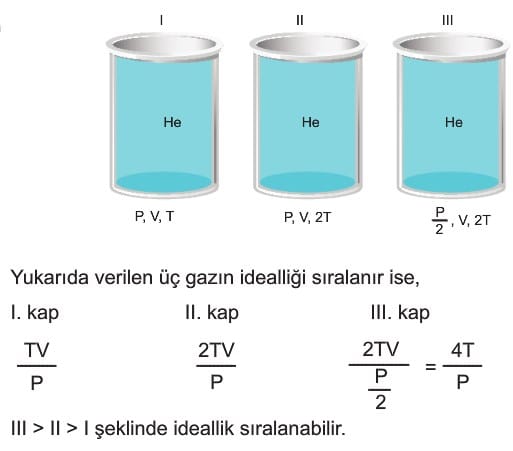
İdeal Gaz: Kinetik teorideki koşulları sağlayan gazlar ideal gaz olarak kabul edilir. Gazın ideale yaklaşması sıcaklığının ne kadar yüksek ve basıncının ne kadar düşük olduğuna bağlıdır. Sıcaklığı arttıkça ve basıncı azaldıkça gaz ideale yaklaşır. Aynı şartlarda bulunan farklı gazlarda ise molekül ağırlığı ve polarlığı arttıkça ideallikten uzaklaşır.
Gazlarda Kinetik Teori Soruları ve Çözümleri
Çözümlü Örnek Test Soruları
Kinetik teori, gazların özelliklerini moleküllerin hareketleriyle açıklayan bir modeldir. Gaz moleküllerinin sürekli hareket halinde olduğu ve bu hareketin sıcaklığa bağlı olduğu düşünülür. Gaz moleküllerinin hızları ve çarpışmaları, gazın basınç ve sıcaklığıyla doğrudan ilişkilidir.
1. Aynı sıcaklıkta iki farklı gazın molekülleri arasında kütle farkı varsa, bu iki gazın moleküllerinin ortalama hızları nasıl karşılaştırılır?
A) Kütlesi büyük olan gazın molekülleri daha hızlıdır.
B) Kütlesi küçük olan gazın molekülleri daha hızlıdır.
C) Her iki gazın moleküllerinin ortalama hızları aynıdır.
D) Hızlar kütleyle doğrudan orantılıdır.
Çözüm: Kinetik teoriye göre, aynı sıcaklıkta daha küçük kütleli gaz molekülleri daha hızlı hareket eder. Çünkü kinetik enerji eşittir, ancak kütle küçüldükçe hız artar. Cevap B.
2. Bir gaz molekülünün hızının artması hangi durumda gerçekleşir?
A) Basınç azaldığında
B) Sıcaklık arttığında
C) Hacim azaldığında
D) Gaz miktarı azaldığında
Çözüm: Kinetik teoriye göre, bir gazın sıcaklığı arttığında moleküller daha hızlı hareket eder. Cevap B.
3. Sabit hacimde tutulan bir kap içindeki gazın sıcaklığı artırıldığında, gazın basıncı neden artar?
A) Moleküllerin çarpışma sıklığı artar.
B) Moleküllerin sayısı artar.
C) Moleküller birbirine daha çok yaklaşır.
D) Gazın yoğunluğu artar.
Çözüm: Sıcaklık arttığında, gaz moleküllerinin kinetik enerjisi artar ve daha sık çarpışmaya başlarlar, bu da basıncın artmasına neden olur. Cevap A.
4. Bir gazın sıcaklığı düşürüldüğünde moleküllerinin ortalama kinetik enerjisi ve çarpma sıklığı nasıl değişir?
A) Kinetik enerji artar, çarpma sıklığı azalır.
B) Kinetik enerji ve çarpma sıklığı azalır.
C) Kinetik enerji azalır, çarpma sıklığı artar.
D) Kinetik enerji sabit kalır, çarpma sıklığı azalır.
Çözüm: Sıcaklık düştüğünde, gaz moleküllerinin kinetik enerjisi ve çarpma sıklığı azalır. Cevap B.
5. Aynı koşullar altında (sıcaklık ve basınç), farklı gazların moleküllerinin ortalama kinetik enerjileri için ne söylenebilir?
A) Daha ağır olan moleküller daha büyük kinetik enerjiye sahiptir.
B) Daha hafif olan moleküller daha büyük kinetik enerjiye sahiptir.
C) Gazların ortalama kinetik enerjileri aynıdır.
D) Moleküllerin kütlelerine bağlıdır.
Çözüm: Kinetik teoriye göre, aynı sıcaklıktaki tüm gazların ortalama kinetik enerjisi aynıdır. Cevap C.
6. Kapalı bir kapta bulunan gazın sıcaklığı artırıldığında, moleküllerinin hızlarının artması gazın basıncını nasıl etkiler?
A) Basınç artar çünkü çarpışmalar daha sık ve güçlü olur.
B) Basınç azalır çünkü moleküller birbirine daha çok yaklaşır.
C) Basınç değişmez çünkü moleküllerin kütlesi sabit kalır.
D) Basınç azalır çünkü çarpışmalar azalır.
Çözüm: Sıcaklık arttıkça moleküllerin kinetik enerjisi artar ve çarpışmalar daha sık ve güçlü hale gelir, bu da basıncı artırır. Cevap A.
Alternatif Test Soruları
1. Kinetik teori ile ilgili aşağıdaki ifadelerden hangisi yanlıştır?
A) Gaz molekülleri sürekli hareket halindedir
B) Moleküller arası çekim kuvvetleri ihmal edilebilir
C) Moleküllerin hacmi gazın toplam hacmine göre önemlidir
D) Çarpışmalar esnektir
Çözüm:
Kinetik teoriye göre gaz moleküllerinin hacmi toplam hacim yanında ihmal edilebilir. Doğru cevap C‘dir.
2. Aynı sıcaklıktaki O₂ ve He gazları için:
I. Ortalama kinetik enerjileri
II. Molekül hızları
III. Difüzyon hızları
Niceliklerinden hangileri farklıdır?
A) Yalnız I
B) I ve II
C) II ve III
D) I, II ve III
Çözüm:
Aynı sıcaklıkta ortalama kinetik enerji aynıdır, ancak hızlar ve difüzyon hızları farklıdır. Doğru cevap C‘dir.
3. Bir gazın sıcaklığı 2 katına çıkarılırsa, moleküllerin ortalama hızı kaç katına çıkar?
A) √2
B) 2
C) 4
D) 8
Çözüm:
Ortalama hız √T ile orantılıdır. √2 katına çıkar. Doğru cevap A‘dır.
4. Kinetik teoriye göre gaz basıncının temel nedeni:
A) Moleküllerin hacmi
B) Moleküllerin kütlesi
C) Moleküllerin çarpışmaları
D) Moleküller arası çekim kuvvetleri
Çözüm:
Gaz basıncı, moleküllerin kabın çeperlerine çarpması sonucu oluşur. Doğru cevap C‘dir.
5. Graham difüzyon kanununa göre, aynı koşullardaki CH₄ ve O₂ gazlarının difüzyon hızları oranı (rCH₄/rO₂) kaçtır? (H:1, C:12, O:16)
A) 1/2
B) 2
C) √2
D) 1/√2
Çözüm:
r₁/r₂ = √(M₂/M₁) formülüne göre √(32/16) = √2 bulunur. Doğru cevap C‘dir.
6. İdeal gaz davranışından sapmaya neden olan etken:
A) Yüksek sıcaklık
B) Düşük basınç
C) Moleküller arası çekim kuvvetleri
D) Küçük molekül kütlesi
Çözüm:
İdeal gazdan sapma, moleküller arası çekim kuvvetleri ve molekül hacmi nedeniyle olur. Doğru cevap C‘dir.