Gaz Yasaları 11. sınıf kimya
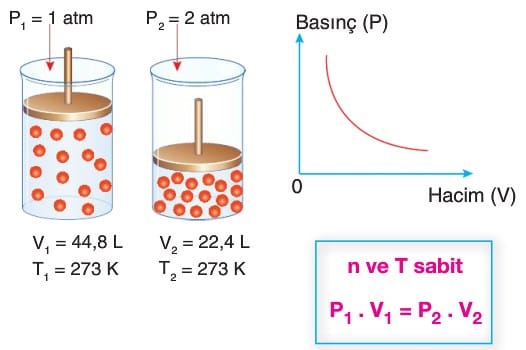
Boyle Yasası (Basınç-Hacim ilişkisi)
- Gazlar sıkıştırılabilirler. Gazların sıkıştırılabilme kanunu 1662’de İngiltere’de Robert Boyle ve 1676’da Fransa’da Edme Mariotte tarafından bulunmuştur. Bu nedenle bu kanun Boyle-Mariotte Yasası olarak da bilinir.
- Bu yasaya göre bir miktar gaz, sabit sıcaklıkta sıkıştırılırsa basıncı artar. Yani basınç ile hacmin çarpımı sabittir.
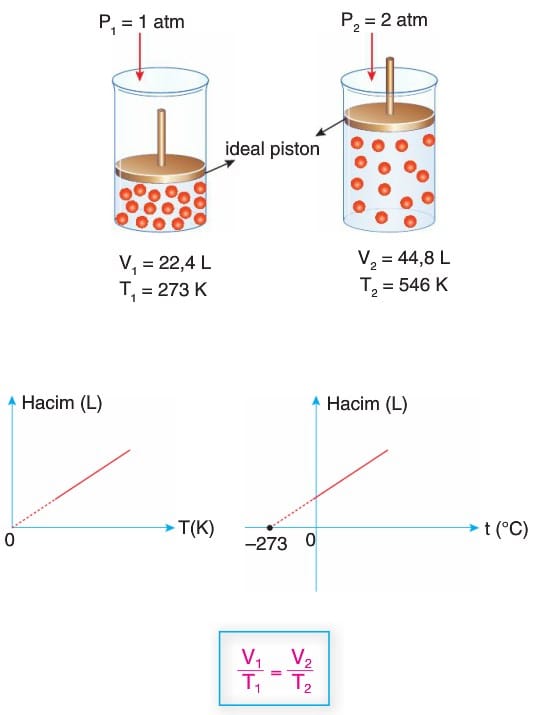
Charles Yasası (Hacim-Sıcaklık İlişkisi)
- Yasa, ilk defa, .Joseph Louis Gay-Lussac tarafından 1802’de yayımlanmıştır. Ancak bu yayımda, 1787’de yazılıp yayımlanmayan Jacques Charles’ın bir yapıtına referansta bulunulmuştur. Bu nedenle de, yasa, CharIes’ın adıyla anılmaktadır. Gazlar arasındaki bu ilişki, 1702’de Guillaume Amontons tarafından da keşfedilmişti.
- Bu yasaya göre bir miktar gaz sabit basınçta ısıtılırsa hacmi artar.
Uyarı: Gazlarla yapılan tüm işlemlerde sıcaklık birimi olarak Kelvin (K) kullanılın
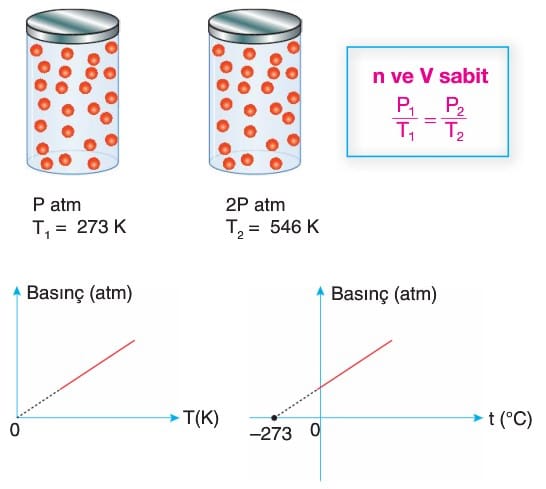
Gay-Lussac Yasası (Basınç-Sıcaklık İlişkisi)
- Bu yasa, Fransız kimyacı Joseph Louis Gay-Lussac’ın adıyla anılır. Gay-Lussac’a mal edilen, iki tane gaz yasası vardır. İkisi de aynı isimle anılırlar. Gazlarla yaptığı “Sıcaklık değişiminin inciler üzerindeki basınç değişimi” deneyini dedesi Mark Lussac ile yapmıştır.
- Bu yasaya göre bir miktar gaz sabit hacimli kapta ısıtılırsa basıncı artar.
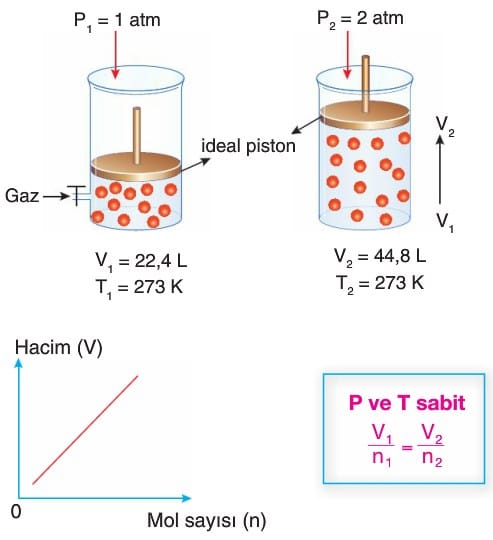
Avogadro Yasası (Hacim-Mol Sayısı İlişkisi)
- Avogadro yasası (Avogadro hipotezi olarak da bilinir), Amedeo Avogadro’nun 1811’de bulduğu bir gaz yasasıdır.
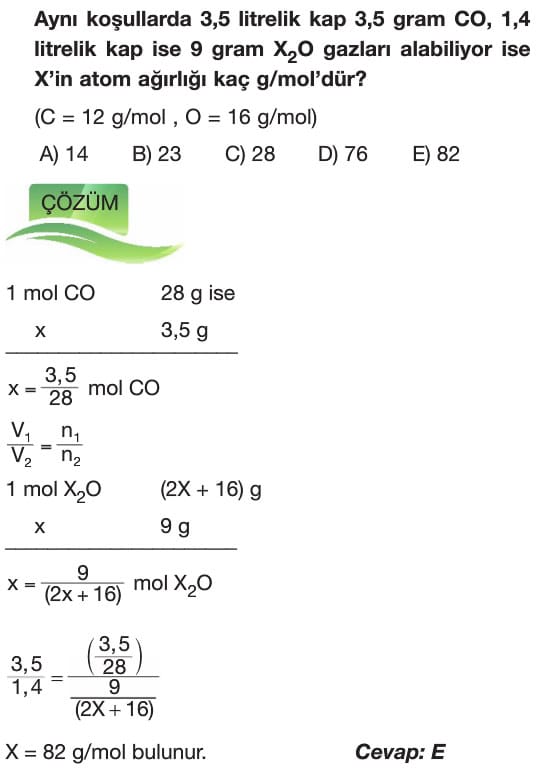
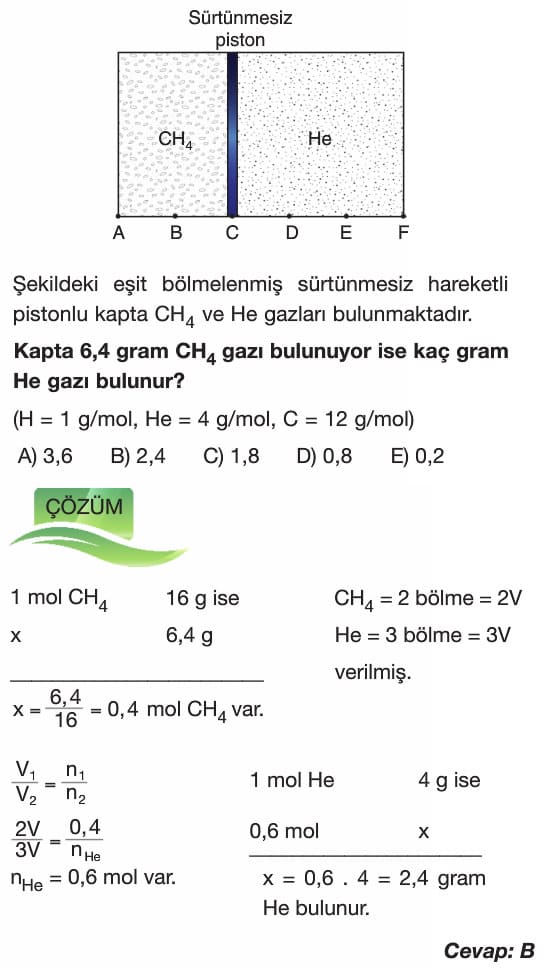
- Bu yasaya göre aynı sıcaklık ve basınçta eşit hacimli gazlar aynı sayıda parçacık ya da molekül sayısına sahiptir.
- Avogadro yasası, toplam gaz yasasını oluşturan Boyle yasası, Charles yasası ve Gay-Lussac yasasıyla birlikte ideal gaz yasasını oluşturur.
- Bir maddenin 1 molünün kapladığı hacme molar hacim denir.
- Gazların molar hacmi basınç ve sıcaklığa da bağlıdır.
- Normal koşullarda (NK), yani 0 oC sıcaklık ve 1 atm basınç altında tüm gazların molar hacmi 22,4 Iitredir.
- Standart koşullarda (oda şartları) yani 25 oC sıcaklık ve 1 atm basınç altında tüm gazların molar hacmi 24,5 litredir.
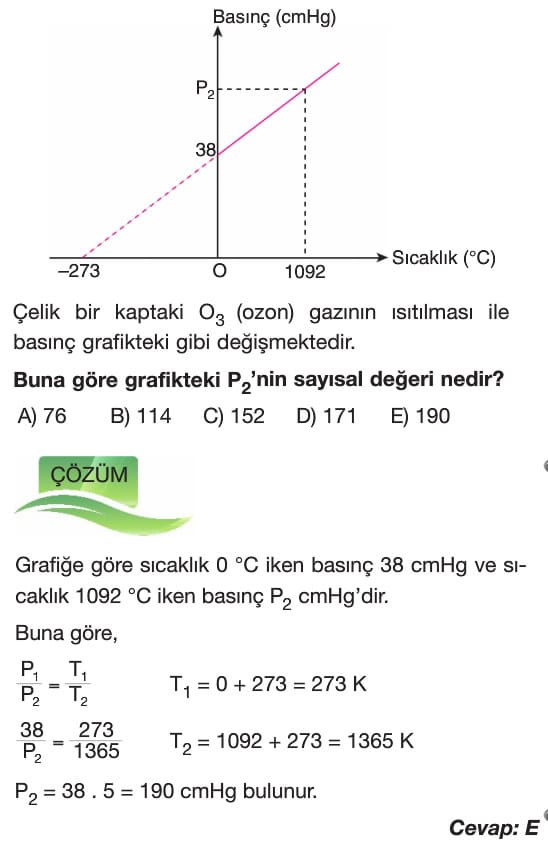
Gaz Yasaları konu anlatımı soruları çözümleri özet 11. sınıf kimya
Uçan Balon: Balon, ısıtılmış hava ya da havadan yoğunluğu az olan bir gaz ile (helyum, hidrojen gibi) doldurulan atmosferde uçabilen ve altına sepet bağlanarak insan ve yük taşımacılığında kullanılan ilk hava taşıtıdır.
Uçma prensibi: Havanın kaldırma kuwetinden yararlanılır. Balonun hacminin kapladığı havanı ağırlığı, kendi ağırlığına eşit olana kadar yükselir. Atmosferde yukarı çıkıldıkça atmosferin yoğunluğu azaldığı için, balonun hacmi artırılarak yoğunluğu azaltılır veya ağırlığı azaltılır. Alçalmak istendiğinde de balon hacmi küçültülerek aşağıya iniş sağlanır. Bilimsel anlamda ilk uçuşu Fransız fizikçi Jean Baptiste Biot ve Joseph Louis Gay Lussac 1804 yılında 6,5 km yükseğe çıkarak yapmışlardır.