Gaz Karışımları Kimya Ayt
GAZ KARIŞIMLARI
Gazlar
Gazlar difüzyonla birbirleri içinde her oranda karışabilirler. Tüm gaz karışımları homojendir. Günlük hayatta gazları çoğu zaman karışım halde kullanırız. Yeryüzünün etrafını saran atmosfer bir gaz karışımıdır.
Dalton Kısmi Basınçlar Yasası
John Dalton, gaz karışımlarının davranışlarını ilk defa inceleyen bilim insanıdır. Kapalı bir kapta bulunan gaz karışımındaki her bir gazın aynı kapta tek başına bulunduğunda uygulayacağı basıncı kısmi basınç olarak tanımlamıştır.
Kısmi Basınçlar Yasasına Göre:
1) Bir gaz karışımının toplam basıncı, içerisindeki bileşenlerinin kısmi basınçlarının toplamıdır.
2) Her bir gazın kısmi basıncı sahip olduğu taneciklerinin mol sayısı ile doğru orantılıdır.
Gazların Su Üstünde Toplanması
Kimyasal tepkimelerde oluşan gazların hacimleri farklı deneysel yöntemlerle belirlenebilir.
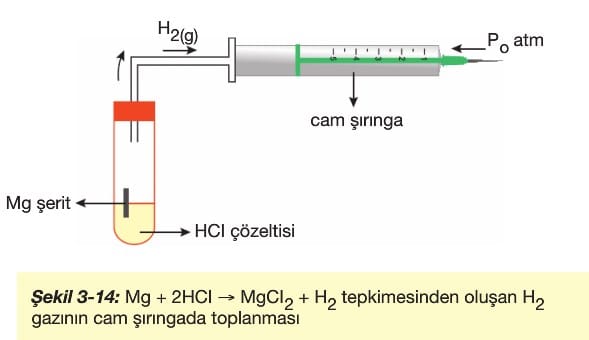
1) İdeal pistonlu kapta toplama. (Şekil 3-14)
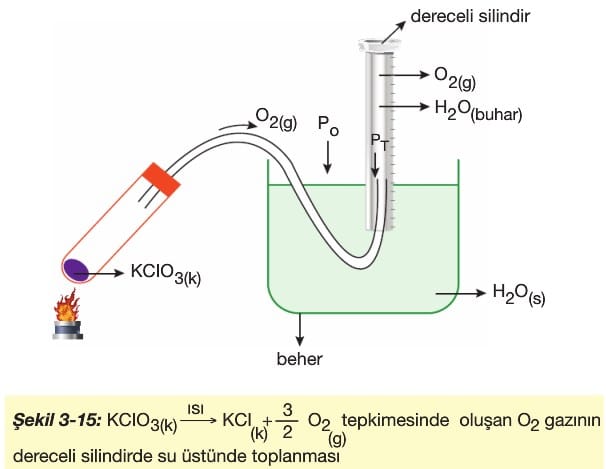
2) İçi su dolu dereceli silindirde su üstünde toplama. (Şekil 3-15)
Şekil 3-14’de tepkimede açığa çıkan H2 gazının hacmi cam şırıngada pistonun hareketi durduğu anda kapladığı hacim belirlenerek bulunur. Belirlenecek hacim değeri H2 gazının atmosfer basıncı altında kapladığı hacmi gösterir.
Buhar Basıncına Etki Eden Faktörler
Buhar basıncı sıvının cinsine, saf olup olmamasına ve sıcaklığına bağlıdır.
Sıvının cinsi:
Sıvının molekülleri arasındaki etkileşim kuvvetlerinin türü ve çekim gücü sıvının buhar basıncını etkiler. Örneğin; 25 oC sıcaklıkta saf suyun buhar basıncı 24 mmHg, saf etil alkolün buhar basıncı ise 55 mmHg dır. Aynı sıcaklıkta, etanolün buhar basıncının saf suyunkinden yüksek olmasının nedeni molekülleri arasındaki çekim kuvvetlerinin
suya göre daha zayıf olmasındandır. Kısacası, aynı koşullarda etanol sudan daha hızlı buharlaşır.
Sıvının saflığı:
Sıvıların içerisinde ucucu olmayan (NaCI gibi) bir katı çözündüğünde sıvının buhar basıncı azalır. Bu durum bir sonraki “Çözeltiler” ünitesinde “Koligatif özellikler” konusunda açıklanacaktır.
Sıvının sıcaklığı:
Sıvıların sıcaklığı artırıldıkça moleküllerinin kinetik enerjisi ve hızı artar. Buna bağlı olarak, moleküller arası çekim kuvvetleri zayıflar. Daha hızlı buharlaşan sıvının buhar basıncı artar.
Denge (Doygun) Buhar Basıncı
Saf bir sıvının buhar basıncı sadece sıcaklığa bağlıdır ve sıcaklık arttıkça artar. Sıvılar için verilen buhar basıncı değerleri o sıvıların denge buhar basıncı değerleridir. Kapalı bir kapta, buharlaşma hızının yoğunlaşma hızına eşit olduğu andaki basınca sıvı-buhar denge basıncı denir.