Elementlerin Sınıflandırılması 8.Sınıf Fen
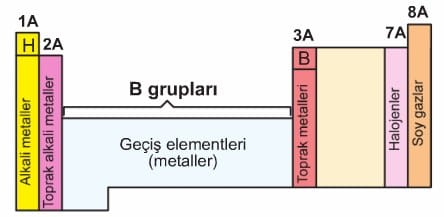
Önemli grupların isimleri şöyledir:
- 1A grup elementlerine: Alkali metaller
- 2A grup elementlerine: Toprak alkali metaller
- 7A grup elementlerine: Halojenler
- 8A grup elementlerine: Soy gazlar
adı verilir.
Periyodik cetvelin 2 A ile 3 A grupları arasındaki çukur bölgede B grubu elementleri bulunur. B grubu elementlerine geçiş elementleri denir. Hepsi metaldir. Periyodik cetvelin 1. periyodunda 2, 2. ve 3. periyotlarında 8 element bulunur. İlk üç periyotta B grubu elementi yoktur. B grupları 4. periyotta başlar.
Alkali Metaller
Soy gazlardan bir sonra gelirler. Bulundukları periyodun ilk elementleridir. Atom numaraları kendilerine en yakın soy gazınkinden bir fazladır. Değerlik elektron sayısı 1 dir. (+) yüklü iyonları soy gaz elektron düzenindedir. En kolay elektron veren (en aktif) metal grubudur. Doğada atomik halde bulunurlar.
UYARI: 1A grubunun ilk elementi olan hidrojen alkali metal değil, ametaldir.
İyonlaşma enerjileri (elektron kopartmak için gereken enerji)) küçüktür.
Toprak Alkali Metaller
Soy gazlardan iki sonra gelirler. Periyotlarının ikinci elementleridir. Atom numaraları kendilerine en yakın soy gazınkinden iki fazladır. Değerlik elektron sayıları 2 dir. (2+) yüklü iyonları soy gaz elektron düzenindedir. Alkali metallerden sonra en kolay elektron veren metal grubudur.
Halojenler
Hepsi ametaldir. Soy gazlardan bir önceki gruptur. Atom numaraları en yakın soy gazınkinden bir eksiktir. En kararlı iyonları (1-) yüklüdür. Çeşitli (+) değerlikleri de alabilirler. Bulundukları periyodun en kolay elektron alan (en aktif) ametal grubudur. Doğada iki atomlu moleküller halinde bulunurlar. İyonlaşma enerjileri yüksektir.
Soy Gazlar
Elementler Kendi Aralarında Sınıflara Ayrılır
Şu ana kadar bulunmuş olan elementler farklı farklı özelliktedir. Fiziksel bir takım özelliklere göre elementleri metal, ametal ve yarı metal olmak üzere üçe ayırabiliriz. Günlük hayattan bildiğimiz genellikle katı olan demir, gümüş, altın gibi yüzeyleri parlak olan, tel ve levha hâline getirilebilen elementlere metal denir. Metaller genelde doğada bulunurlar.
Genellikle gaz olan ve havada bulunan oksijen, hidrojen, azot gibi maddeler de ametaldir. Ametaller tel ve levha hâline getirilemezler, metaller gibi parlak değildirler ve erime ve kaynama noktaları yüksek değildir. Metal, ametal ve yarı metallerin özelliklerini aşağıdaki şekilde maddeleştirebiliriz.
Metaller
- Oda sıcaklığında cıva dışında katı hâldedirler.
- Tel ve levha hâline getirilebilirler. (Bu nedenle haddelenme özellikleri vardır.)
- Görünümleri parlaktır.
- Sıcaklık yükseldikçe elektrik iletkenlikleri azalma gösterir.
- Elektriği ve ısıyı iyi iletirler.
- Sadece ametallerle bileşik oluşturulabilirler.
- Sert veya yumuşak olabilirler.
- Sert olan yumuşak olanı çizer.
Yarı metaller
- Yüzeyleri parlak veya mat olabilirler.
- Elektriği çok az iletebilirler.
- Sıcaklık yükseldikçe elektrik iletkenlikleri artar.
- Doğada katı hâlde bulunurlar.
- Dövülerek işlenebilirler.
Ametaller
Bilinen elementlerden sadece 17 tanesi ametaldir. Hidrojen(H), Oksijen(O), Azot(N), Kükürt(S), Klor (Cl), Br0m(Br), Iyot(I) ve Karbon(C) elementleri yaygın olarak karşılaşılan ametallerdir.
- Elektrik ve ısıyı iyi iletmezler.
- Oda sıcaklığında katı, sıvı ve gaz hâlinde bulunabilirler.
- Yüzeyleri mat görünüşlüdür.
- Tel ve levha haline getirilemezler. (Haddelenme özellikleri yoktur.)
- Hem metallerle hem de kendi aralarında bileşik oluşturabilirler.
Soy gazlar
- Soy gazların (Helyum hariç) son enerji düzeyinde 8 elektron bulunur.
- Elektrik akımını iletmezler.
- Oda sıcaklığında tek atomlu gaz hâlinde bulunurlar.
- Bileşik oluşturmazlar.
- Periyodik cetvelde 8A grubunda yer alırlar.
- Atomik hâlde bulunurlar.
Elementler ve Kullanım Alanları
Doğadan elde ettiğimiz metalleri, ametalleri ve yarı metalleri günlük yaşantımızın pek çok alanında kullanırız. Metallerin birçok benzer özellikleri olmasına rağmen, her metalin kendine ait özellikleri vardır. Bu nedenle farklı metallerin kullanım alanları da farklıdır. Örneğin; krom ve titanyum gibi metaller sürtünmeye karşı oldukça dirençlidir. Bu nedenle, sürekli çalışan motorların ve araçların hareketli parçalarının yapımında kullanılırlar. Kalsiyum, doğada bileşikler hâlinde bulunur. Bileşiklerden biri kalsiyum karbonattır ve kireç taşı olarak bilinir. Özellikle boya yapımında kullanılır. Yarı metallerde ise; özellikle silisyum ve germanyum elektronik sanayinin temel yapı taşı gibidir. Elektronik devre elemanlarında kullanılarak olması gerekenden çok daha küçük cihazlar ve aletler yapılabilmektedir. Bor ise, ısıya dayanıklı cam imalatında, seramiklerde ve roket yakıtlarında kullanılır.
Bir ametal olan flor, diş macunlarında ve deodorantların yapımında kullanılır. Fosfor suni gübre yapımında ve sıvı azotu soğutma amacıyla kullanılır. Azotlu bileşikler ise tarımda gübre yapımında kullanılır.