Elektronegatiflik 9. Sınıf Kimya
Elektronegatiflik, bir atomun kimyasal bağ sırasında ortaklaşa kullanılan elektronları kendisine çekme yeteneğidir. Elektronegatifliği yüksek olan atomlar, bağdaki elektronları daha güçlü bir şekilde çekerken, elektronegatifliği düşük olan atomlar elektronları daha az çeker. Elektronegatiflik, atomların kimyasal bağ yapma davranışlarını ve bileşiklerin polaritesini anlamada önemli bir kavramdır.
İki atom arasında oluşan bir bağda atomların bağ elektronlarına sahip çıkma eğilimi (çekim kuvveti) elektronegatiflik olarak adlandırılır.
- Bir atomun elektronları çekme gücüdür.
- Elektronegatifliği en fazla olan element Flor’dur. Yani elektronegatiflik flora (F) doğru artar. (Yani ametalik özelliğin arttığı yönde artar)
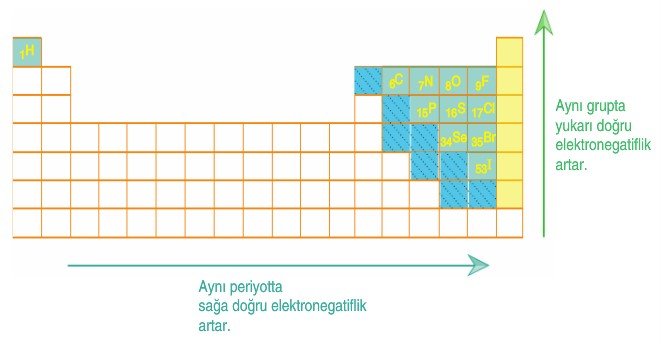
- Aynı periyotta sağa doğru gidildikçe elektronegatiflik artar. Aynı Grupta yukarı doğru gidildikçe elektronegatiflik artar.
Bazı elementlerin elektronegatiflik değerleri şunlardır:
- Hidrojen: 2.20
- Oksijen: 3.44
- Flor: 3.98
- Sodyum: 0.93
- Klor: 3.16
- Karbon: 2.55
- Lityum: 0.98
Çözümlü Örnek Sorular:
Soru 1:
Periyodik tablonun 2. periyodunda yer alan Lityum (Li), Karbon (C) ve Flor (F) elementlerinin elektronegatiflik değerlerini karşılaştırınız.
Çözüm:
Elektronegatiflik, bir atomun bağ yaptığı diğer atomun elektronlarını çekme yeteneğidir. Periyodik tabloda sağa doğru gidildikçe elektronegatiflik artar.
- Lityum (Li), metallerden biri olup, en düşük elektronegatifliğe sahiptir.
- Karbon (C), ametal olup, elektronegatifliği lityumdan yüksektir.
- Flor (F) ise periyodik tablodaki en yüksek elektronegatifliğe sahip elementtir.
Sonuç: Li < C < F şeklinde bir sıralama yapılabilir.
Soru 2:
Oksijen (O) ve kükürt (S) elementlerinin elektronegatiflik değerlerini karşılaştırınız. Hangi element daha yüksek elektronegatifliğe sahiptir?
Çözüm:
Oksijen ve kükürt, aynı grupta (6A grubu) yer alır. Bir grupta yukarıdan aşağıya inildikçe atom yarıçapı artar ve elektronegatiflik azalır. Oksijen periyodik tabloda kükürdün üstünde yer aldığından, elektronları çekme gücü daha fazladır.
Sonuç: Oksijen (O) elementinin elektronegatifliği kükürtten daha yüksektir.
Soru 3:
Elektronegatiflik farkı sıfıra yakın olan iki atom arasındaki bağın türü nedir?
Çözüm:
Elektronegatiflik farkı sıfıra yakın olan iki atom arasında elektronlar eşit olarak paylaşılır. Bu durumda apolar kovalent bağ oluşur. Örneğin, iki hidrojen atomu (H-H) arasındaki bağ apolar kovalent bağdır, çünkü iki atomun elektronegatiflikleri aynıdır.
Sonuç: Apolar kovalent bağ oluşur.
Soru 4:
Elektronegatifliği yüksek olan atomların genellikle yaptığı bağların türü nedir? Örnek veriniz.
Çözüm:
Elektronegatifliği yüksek olan atomlar genellikle iyonik ya da polar kovalent bağlar yapar. Elektronegatiflik farkı büyükse, elektronlar daha fazla çekilir. Örneğin, sodyum (Na) ve flor (F) arasındaki bağ, sodyumun elektron vermesi ve florun bu elektronu almasıyla oluşur. Bu bağ iyonik bağ olarak adlandırılır.
Sonuç: Elektronegatifliği yüksek atomlar iyonik veya polar kovalent bağlar yapar.
Soru 5:
HF molekülünde flor (F) ve hidrojen (H) arasındaki bağın türü nedir? Florun elektronegatifliği 4.0, hidrojenin elektronegatifliği ise 2.1’dir.
Çözüm:
Elektronegatiflik farkı bağ türünü belirler. Flor ve hidrojen atomlarının elektronegatiflik farkı:
4.0 – 2.1 = 1.9
Elektronegatiflik farkı 1.9 olduğunda polar kovalent bağ oluşur. Flor elektronları daha fazla çektiği için molekülün bir ucu kısmen negatif, diğer ucu kısmen pozitif olur.
Sonuç: HF molekülünde polar kovalent bağ vardır.
Özet:
Elektronegatiflik Değerlerinin Periyodik Tabloya Göre Değişimi
Elektronegatiflik, periyodik tabloda elementin yer aldığı konuma bağlı olarak değişiklik gösterir. İki temel eğilim gözlemlenir:
- Soldan Sağa (Bir Periyotta): Periyodik tablonun solundan sağına doğru gidildikçe elektronegatiflik artar. Bunun nedeni, çekirdek yükünün artmasıyla elektronların çekirdeğe daha sıkı bağlanmasıdır. Özellikle sağ tarafta yer alan ametallerin elektronegatifliği yüksektir. Flor (F) periyodik tablodaki en elektronegatif elementtir.
- Yukarıdan Aşağıya (Bir Grupta): Aynı grupta yukarıdan aşağıya inildikçe elektronegatiflik azalır. Bunun nedeni, atom yarıçapının büyümesi ve dış elektronların çekirdekten daha uzak olmasıdır. Elektronlar çekirdeğe daha az sıkı bağlandığı için elektronegatiflik düşer.
Elektronegatifliğin Kimyasal Bağlarla İlişkisi
Elektronegatiflik, kimyasal bağın türünü belirlemede kritik bir rol oynar:
- Kovalent Bağlar: İki atomun elektronegatiflik farkı çok küçükse, elektronlar eşit veya hemen hemen eşit şekilde paylaşılır. Bu durumda, bağ kovalent bağ olur. Eğer elektronegatiflik farkı 0 ise, bağ tamamen apolardır.
- Polar Kovalent Bağlar: Eğer iki atom arasındaki elektronegatiflik farkı küçükse (ancak sıfır değilse), bağ polar kovalent olur. Elektronlar, daha elektronegatif olan atomun tarafına daha fazla çekilir.
- İyonik Bağlar: Elektronegatiflik farkı büyükse (genellikle 1,7’den büyük), bağ iyonik bağ olur. Elektronlar tamamen daha elektronegatif olan atoma geçer ve iyonlar oluşur.
Elektronegatifliğin Önemi
Elektronegatiflik, bileşiklerin kimyasal davranışlarını anlamada önemli bir parametredir. Moleküllerin polaritesi, elektron yoğunluğunun hangi atoma doğru kaydığı ve bu bağın ne kadar güçlü olduğu elektronegatifliğe bağlıdır. Elektronegatiflik farkı büyük olan atomlar arasındaki bağlar genellikle daha polar olur, bu da bileşiğin fiziksel ve kimyasal özelliklerini etkiler.
Elektronegatiflik ve Polarite
Bir molekülün polar olup olmadığını anlamak için, moleküldeki atomlar arasındaki elektronegatiflik farklarına bakmak gerekir. Elektronegatiflik farkı yüksek olan atomlar arasında oluşan bağlar, molekülün polar olmasına neden olur. Bu da molekülün dipol momenti, çözünürlük ve kaynama noktası gibi özelliklerini etkiler.