Elektron İlgisi ve Elektronegatiflik 11.Sınıf Kimya
Elektron İlgisi ve Elektronegatiflik
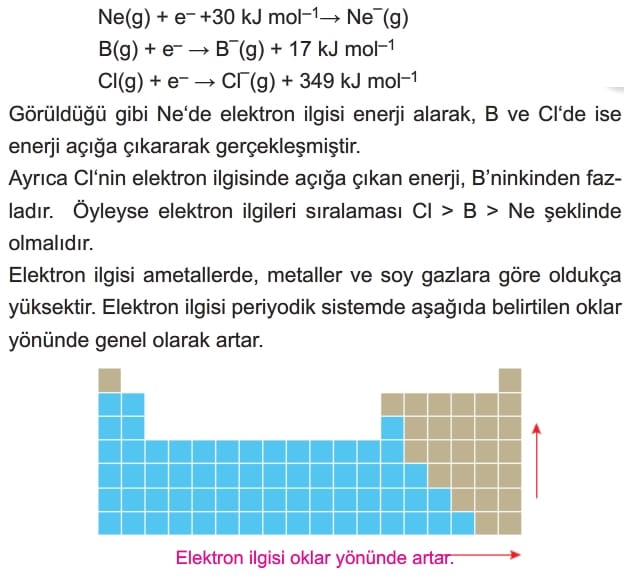
Elektron İlgisi
Gaz hâlindeki bir atom elektron aldığında meydana gelen enerji değişimine elektron ilgisi denir.
![]()
Bu olay enerji açığa çıkararak gerçekleşiyorsa elektron ilgisi yüksek, enerji alarak gerçekleşiyorsa elektron ilgisi çok düşük olur. Örneğin Ne, B ve CI element atomlarının elektron ilgisi denklemleri aşağıdaki gibidir.
Elektronegatiflik
Kimyasal bir bağı oluşturan atomların bağ elektronlarını kendine çekme gücüne elektronegatiflik denir. Bir kimyasal bağda, elektronegatifliği yüksek olan atom bağ elektronlarını kendine doğru çekerek kısmi negatif yük (δ-) kazanır, elektronegatifliği düşük olan diğer atom ise kısmi pozitif yük (δ+) kazanmış olur.
Örneğin HF molekülündeki bağda, bağ elektronları F atomları tarafından daha çok çekilir. Bu nedenle molekülde F atomu kısmi negatif yükle, H atomu ise kısmi pozitif yükle yüklenir.
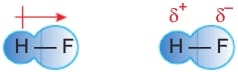
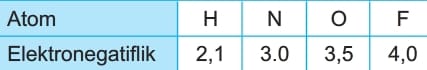
Atomların bağıl elektronegatiflikleri O ile 4 arasında değişen değerlerle kıyaslanır. Örneğin flor, oksijen, azot ve hidrojen atomunun
elektronegatiflik değerleri aşağıdaki tablodaki gibidir.
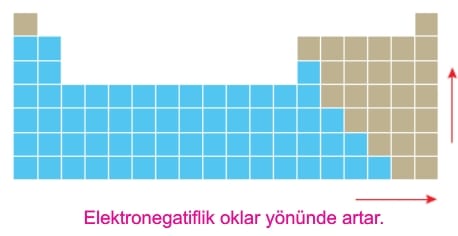
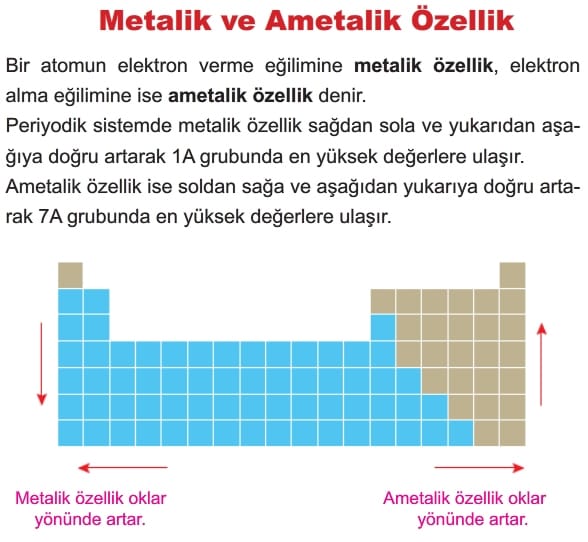
Elektronegatiflik ametallerde yüksek, metallerde düşük, soy gazlarda ise yok denecek kadar azdır.
Elektronegatiflik periyodik sistemde aşağıda belirtilen oklar yönünde belirgin olarak artar.
Çokbasit ve açıklayıcı perfecto
İstisnalara fazla değinmemişsiniz.
Gayet açıklayıcı bir konu olmuş gerçekten. Çok teşekkür ederiz. 🙂