Elektroliz 9. Sınıf Kimya
Elektroliz, elektrik akımının bir çözelti veya eriyikteki bir bileşikten metal veya hidrojen gibi diğer maddelerin ayrılmasını sağlayan bir işlemdir. Elektroliz, endüstriyel ve bilimsel uygulamalarda yaygın olarak kullanılmaktadır.
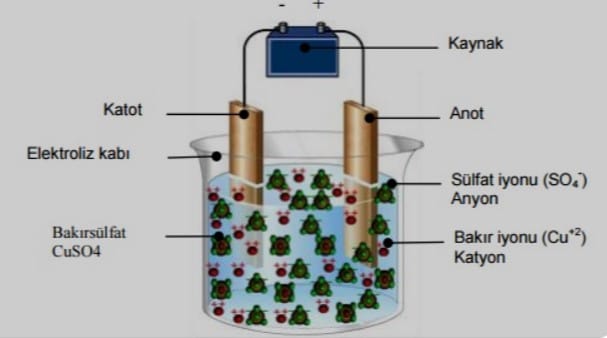
Elektroliz işlemi, bir elektroliz hücresi içinde gerçekleşir. Elektroliz hücresi, iki elektrottan ve bir çözeltiden veya eriyikten oluşur. Elektrotlardan biri, metal veya hidrojen üretmek için kullanılan katot olarak adlandırılır. Diğer elektrot, oksijen veya başka bir element üretmek için kullanılan anot olarak adlandırılır.
Elektrik akımı, elektrotların arasından akar. Bu akım, çözeltideki veya eriyikteki iyonları hareket ettirir. Katot, elektronları kabul eden bir elektrottur. Bu, iyonların elektron kazanmasına ve metal veya hidrojen atomlarına dönüşmesine neden olur. Anot, elektronları veren bir elektrottur. Bu, iyonların elektron kaybetmesine ve oksijen veya başka bir element atomlarına dönüşmesine neden olur.
Elektroliz işleminin birkaç farklı türü vardır. En yaygın elektroliz türleri şunlardır:
- Metal elektroliz, bir metalin bir çözelti veya eriyikten ayrılmasını sağlar. Örneğin, bakır elektroliz, bakır cevherinden bakır elde etmek için kullanılır.
- Hidrojen elektroliz, suyun hidrojen ve oksijene ayrılmasını sağlar. Bu, hidrojen yakıt hücreleri gibi uygulamalarda kullanılır.
- Sodyum elektroliz, sodyumun bir çözelti veya eriyikten ayrılmasını sağlar. Bu, sodyum bileşikleri üretmek için kullanılır.
Elektroliz, endüstriyel ve bilimsel uygulamalarda yaygın olarak kullanılmaktadır. Bazı yaygın elektroliz uygulamaları şunlardır:
- Metallerin üretimi
- Hidrojen üretimi
- Sodyum üretimi
- Plastik üretimi
- Atık su arıtımı
Elektroliz, kimya alanında önemli bir işlemdir. Bu işlem, metallerin üretimi, hidrojen üretimi ve diğer kimyasal işlemlerin gerçekleştirilmesi için kullanılır.